Amonyak
| Amonyak | |
|---|---|
 | |
 | |
 | |
| Azan | |
| Diğer adlar Hidrojen nitrür Nitro-Sil | |
| Tanımlayıcılar | |
| CAS numarası | 7664-41-7 |
| PubChem | 222 |
| EC numarası | 231-635-3 |
| UN numarası | 1005 |
| KEGG | D02916 |
| ChEBI | 16134 |
| RTECS numarası | BO0875000 |
| SMILES |
|
| InChI |
|
| Beilstein | 3587154 |
| Gmelin veritabanı | 79 |
| ChemSpider | 217 |
| 3DMet | B00004 |
| Özellikler | |
| Molekül formülü | NH3 |
| Molar kütle | 17.031 g/mol |
| Görünüm | Renksiz gaz |
| Koku | Güçlü acı koku |
| Yoğunluk | 0.86 kg/m3 (kaynama noktasında 1.013 bar) 0.769 kg/m3 (Standart koşullarda)[1] |
| Erime noktası |
−77.73 °C (−107.91 °F; 195.42 K) |
| Kaynama noktası |
−33.34 °C (−28.01 °F; 239.81 K) |
| Çözünürlük (su içinde) | 47% kütle/kütle (0 °C) 31% kütle/kütle (25 °C) 18% kütle/kütle (50 °C)[4] |
| Çözünürlük () | Kloroform, eter, etanol ve metanolde çözünür. |
| Buhar basıncı | 8573 h Pa |
| Asitlik (pKa) | 32.5 (−33 °C),[5] 10.5 (DMSO) |
| Baziklik (pKb) | 4.75 |
| Tehlikeler | |
| R-ibareleri | R10, R23, R34, R50 |
| NFPA 704 |
 1
3
0
|
| Parlama noktası | Yanıcı gaz |
| Öztutuşma sıcaklığı |
651 °C (1,204 °F; 924 K) |
| Patlama sınırları | 15–28% |
| ABD maruz kalma limiti (PEL) |
50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) |
| LD50 | 0.015 mL/kg (insan, oral) |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
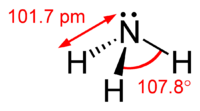
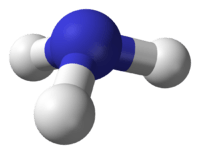
Amonyak, formülü NH3 olan; azot atomu ve hidrojen atomundan oluşan renksiz , keskin ve hoş olmayan kokuya sahip bir gaz bileşiğidir. OH- iyonu içermediği halde suda zayıf baz özelliği gösterir. Bir amonyak molekülü, bir azot ve üç hidrojen atomundan oluşur.
Yapısı
Amonyak, kovalent bağlı (ametal + ametal) bir bileşiktir. Molekülleri polar olduğundan su içinde yüksek oranda çözünür. Amonyak molekülleri kendi aralarında olduğu gibi su molekülleri ile de zayıf hidrojen bağı oluşturur. Bu nedenle suda çözünür.
- Yaptığı bileşikte, sp3 hibritleşmesi yapmıştır.
- Bağ yapmamış bir çift elektronu olduğundan molekül şekli üçgen piramittir, bu yüzden polar bir moleküldür.
- Gazlaşma gizli ısısı çok yüksektir, bu nedenle sanayi tesislerinde soğutucu madde olarak da kullanılır.
Çözünürlüğü
- Oda koşullarında doymuş amonyak çözeltisi %34'lük olup, yoğunluğu 0,88 g/ml'dir.
- 1 atm basınç ve 0 °C de 1300 litre, 1 atm basınç ve 20 °C de 700 litre amonyak çözünür.
- 1 atm basınçta kaynama noktası -33,33 °C (239,82 K) dir. -77,73 °C (195,42 K) donduğundan, oda koşullarında gaz halinde bulunur.
Geçmişi
İsmin kökeni Eski Mısır'a dayanır. Amon tapınağını ısıtmada kullanılan deve tezeklerinden çıkan gazlardan, tapınağın duvarlarında, tavanında sofra tuzu gibi beyaz kristaller halindeki amonyum klorür yani nişadır birikmiştir. Buna da o dönemde "Amon'un Tuzu" denilmiş.
Günlük hayatta kullanımı
Amonyak, gübre, ilaç, boya, parfüm gibi maddelerin sentezlenmesinde ilk aşamada kullanılmaktadır. Amonyak canlılar için zehirli bir maddedir, kullanılırken dikkat edilmesi gerekir. Piyasada amonyak adı altında satılan maddeler amonyağın sulu çözeltisi olan Amonyum Hidroksittir.
Kullanım alanları
Kullanım alanları aşağıda belirtilmiştir:
- Boyalarda
- Parfümlerde
- Temizlik malzemelerinde
- Patlayıcılarda
- Gübre yapımında
- Sanayide
- Nitrik asitin üretiminde
- Ürede
- Plastiklerde
Kaynakça
- ↑ "Gases - Densities". 18 Mart 2016 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20160318163337/http://www.engineeringtoolbox.com/gas-density-d_158.html. Erişim tarihi: 3 March 2016.
- ↑ Yost, Don M. (2007). "Ammonia and Liquid Ammonia Solutions". Systematic Inorganic Chemistry. READ BOOKS. s. 132. ISBN 1-4067-7302-6. https://books.google.com/?id=qPGzhL3Y50YC&pg=PA132.
- ↑ Blum, Alexander (1975). "On crystalline character of transparent solid ammonia". Radiation Effects and Defects in Solids 24 (4): 277. DOI:10.1080/00337577508240819.
- ↑ Budavari, Susan, ed. (1996). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th bas.). Merck. ISBN 0-911910-12-3.
- ↑ Perrin, D. D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed., Pergamon Press: Oxford, 1982.