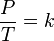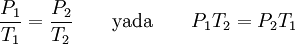Gay-Lussac yasası
Gay-Lussac yasası, (toplam hacim yasası olarak da bilinir) Fransız kimyacı Joseph Louis Gay-Lussac'ın adıyla anılır. Gay-Lussac'a mal edilen, iki tane gaz yasası vardır. İkisi de aynı isimle anılırlar.En ünlü deneyi gazlarla yaptığı sıcaklık değişiminin inciler üzerindeki basınç değişimini dedesi Mark Lussac ile yapmıştır.
Gay-Lussac yasasına göre, bir ideal gazın toplam hacminin, hacimlerinin çarpımına oranı küçük tam sayılar halinde gösterilebilir. Bunu, Gay-Lussac 1809'da bulmuştur. 1811'de ise Amedeo Avogadro, bu bulguları kullanarak Avogadro yasasını yaratmıştır.
1802'de bulunan diğer yasa ise belirli bir miktardaki ideal gazın basıncının, kelvin birimiyle belirtilmiş sıcaklığına doğru orantılı olduğunu belirtir. Matematiksel olarak, bu aşağıdaki gibi gösterilebilir:
- P paskal olarak basınç,
- k gaz sabiti (8.3145 J/(mol K)),
- T de Kelvin olarak sıcaklıktır.
Sıcaklık, bir maddenin ortalama kinetik enerjisi olduğu için sıcaklığının arttığında kinetik enerjisinin de arttığı söylenilebilir. Bu durumda, gaz parçacıkları, gazın tutulduğu kabın duvarlarıyla daha çok çarpışacağından, daha çok basınç uygularlar.
Aynı maddenin farklı durumlardaki hallerini karşılaştırmak için, yasa şu şekilde de yazılabilir:
Charles yasası, aynı zamanda Charles ve Gay-Lussac yasası olarak da bilinir, çünkü Charles, Gay-Lussac'ın sonuçlarını kullanarak yasayı bulmuştur. Ancak yakın zamanlarda, Gay-Lussac'ın burdaki yasaya adını verdiğinden kullanımı azalmıştır.
Gay-Lussac yasası, Boyle yasası ve Charles yasası, birlikte toplam gaz yasası'nı ortaya çıkarırlar. Bu yasaya bir de Avogadro yasası'nın eklenmesi, ideal gaz yasasını ortaya çıkarır.