Periyodik asit
| Periyodik asit | |
|---|---|
 |
 |
 |
 |
| Diğer adlar Paraperiyodik asit İyodik(VII) asit Hidrojen periyodat | |
| Tanımlayıcılar | |
| CAS numarası | |
| PubChem | 65185(Ortoperiyodik) |
| SMILES |
|
| InChI |
|
| Özellikler | |
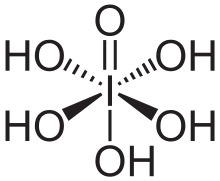
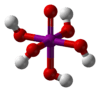
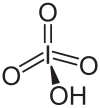
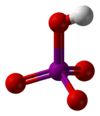
| Molekül formülü | H5IO6 (ortoperiyodik) HIO4 (metaperiyodik) |
| Molar kütle | 227.941 g/mol (H5IO6) 190.91 g/mol (HIO4) |
| Görünüm | Renksiz kristal |
| Erime noktası |
128.5 C[1] |
| Çözünürlük (su içinde) | Alkollerde ve suda çözünür |
| Tehlikeler | |
| R-ibareleri | R23, R24, R25, R34, R41 |
| NFPA 704 |
 0
3
0
OX
|
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
Periyodik asit iyotun en yüksek oksoasiti. Bütün periodatlar gibi iki form halinde var olur: can exist in two forms: H5IO6 formülü ile ortoperiyodik asit ve HIO4 formüllü metaperiyodik asit.
Periyodik asit Heinrich Gustav Magnus ve C. F. Ammermüller tarafından 1833 tarafından keşfedilmiştir.[2]
Sentezi
Modern endüstriyel ölçekli üretimi, PbO2 anotunun üzerinde, iyodik asitin elektrokimyasal oksidasyonunu aşağıdaki standart elektrot potansiyeli ile birlikte içerir:
- H5IO6 + H+ + 2 e− → IO3− + 3 H2O E° = 1.6 V[3]
Ortoperiyodik asit metaperiyodik asit vermesi için 100 °C'de ısıtılarak dehidre edilebilir.
- HIO4 + 2 H2O
 H5IO6
H5IO6
Daha ileri seviyede, 150 °C civarında, ısıtma umulan anhidrat diiyot heptaoksitin (I2O7) yerine iyot pentaoksiti (I2O5) verir. Metaperiyodik asit aynı zamanda çeşitli ortoperiyotadların nitrik asit ile işleminden de elde edilebilir.[4]
- H5IO6 → HIO4 + 2 H2O
Özellikleri
Ortoperiyodik asit çeşitli Ka değerlerine sahiptir. [5][6] Metaperiyodik asitin pKa değeri belirlenememiştir.
- H5IO6
 H4IO6− + H+, pKa = 3.29
H4IO6− + H+, pKa = 3.29
- H4IO6−
 H3IO62− + H+, pKa = 8.31
H3IO62− + H+, pKa = 8.31
- H3IO62−
 H2IO63− + H+, pKa = 11.60
H2IO63− + H+, pKa = 11.60
İki tür periyodik asitin varlığı iki tür periyodat tuzun oluşacağına da işarettir.
Kaynakça
- ↑ Aylett, founded by A.F. Holleman ; continued by Egon Wiberg ; translated by Mary Eagleson, William Brewer ; revised by Bernhard J. (2001). Inorganic chemistry (1st English ed., [edited] by Nils Wiberg. bas.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter.. s. 453. ISBN 0123526515.
- ↑ Ammermüller, F.; Magnus, G. (1833). "Ueber eine neue Verbindung des Jods mit Sauerstoff, die Ueberjodsäure" (German). Annalen der Physik und Chemie 104 (7): 514–525. DOI:10.1002/andp.18331040709.
- ↑ Parsons, Roger (1959). Handbook of electrochemical constants. Butterworths Scientific Publications Ltd. s. 71.
- ↑ Riley, edited by Georg Brauer; translated by Scripta Technica, Inc. Translation editor Reed F. (1963). Handbook of preparative inorganic chemistry. Volume 1 (2nd bas.). New York, N.Y.: Academic Press. s. 323–324. ISBN 012126601X.
- ↑ Aylett, founded by A.F. Holleman; continued by Egon Wiberg; translated by Mary Eagleson, William Brewer; revised by Bernhard J. (2001). Inorganic chemistry (1st English ed., [edited] by Nils Wiberg. bas.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter.. s. 454. ISBN 0123526515.
- ↑ Burgot, Jean-Louis. Ionic equilibria in analytical chemistry. New York: Springer. s. 358. ISBN 1441983821.