Titreşimsel spektroskopi ve izotop etkisi
Spektrumun infrared bölgesi, ışının 12800 ile 10 cm-1 dalga sayılı kısmını kapsar. Hem cihaz hem de uygulama açısından infrared spektrumu; yakın, orta ve uzak infrared ışınları olmak üzere üç bölgeye ayrılır.Titreşimsel spektroskopi spektrumun infrared bölgesinde oluşan moleküler titreşime bağlı olarak ışığın absorplanması ya da saçılmasını inceler. Bu incelemelerin en önemli uygulama alanları endüstriyel, zirai maddeler ve proses kontrolündeki kantitatif ve kalitatif analizlerdir.Işığın frekansı ; elektronların , rezonans frekansı civarında salınımlarına sebep olacak bir frekans değerinde olduğu vakit , genlik öylesine büyüktür ki , ortamın atomları birbirleriyle çarpışırlar ve ışık enerjisinin çoğu iç enerji halini alır ve böylece ortam tarafından emilir. farklı maddelerin elektronları farklı rezonans frekanslarında dır.Bu ise saydam bir cisimden ya da ortamdan geçen görünür ışığı neden görebildiğinizi ve güneş yanıklarına sebep olan ultraviyole frekansların saydam bir cisimden neden geçemediklerini açıklar. bunun sonucunda , kapalı bir havada camdan bakarken güneş yanığınız olmadığı halde , açık havaya çıktığınızda güneş yanığı riskiyle karşı karşıya kalabilirsiniz.
Işığın absorpsiyonu
Işık katı, sıvı veya gaz tabakasına geçtiğinde, bazı dalga boyları absorpsiyon ile seçici olarak ortamdan alınır. Bu süreçte ışık enerjisi numuneyi oluşturan atom, iyon veya moleküllere aktarılır. Absorpsiyon bu parçacıkları temel halden bir veya daha çok sayıdaki yüksek enerjili uyarılmış hallere çıkarır.
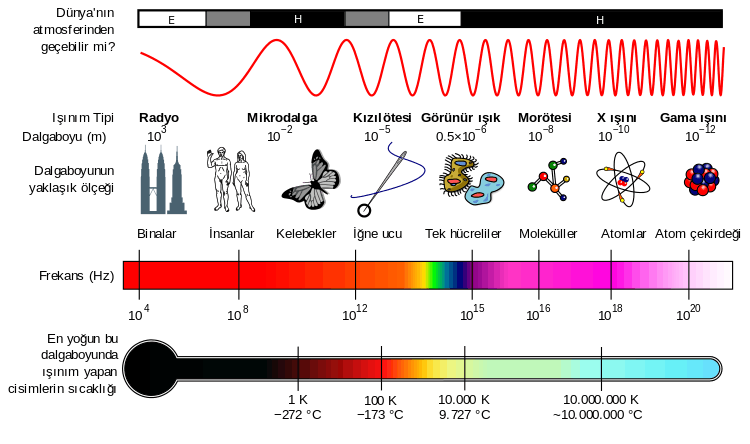
Şekil 2. Işığın elektromanyetik spektrumu
Moleküller ne zaman Infrared ışığı absorplar?
Moleküler maddeler için infrared absorpsiyon spektrumlarının, moleküllerin bir titreşim veya dönme enerji seviyesindeki çeşitli değişimlerden kaynaklandığı varsayılarak açıklanabilir. Infrared ışınını absorplayabilmesi için bir molekülün titreşim veya dönme hareketi sonucunda, molekülün dipol momentinde net bir değişme meydana gelmelidir. Sadece bu şartlar altında, ışının değişen elektrik alanı ile molekül etkileşebilir ve moleküldeki hareketlerin birinin genliğinde bir değişmeye neden olur.
Beer-Lambert Kanunu
Monokromatik ışın için absorbans, ışık yolu b ve absorplayan türün değişimi c ile doğru orantılıdır. Bu bağıntı aşağıda verilmektedir. (en:Beer-Lambert Law)
A=abc a=absorptivite b= hücre uzunluğu c= konsantrasyon
Şekil 3. Beer-Lambert Kanunu
IR Aktif Moleküller
Bir molekülün infrared aktif olabilmesi için titreşimi sırasında net dipol momente sahip olması gerekir. Örneğin hidrojen klorür gibi bir moleülün etrafındaki yük dağılımı, klorun hidrojenden daha çok elektron yoğunluğuna sahip olması nedeniyle, simetrik değildir. Bu nedenle hidrojen klorürün belli bir dipol momenti vardır ve bu moleküle polar molekül denir. Hidrojen klorür titreşirken, dipol momentinde bir değişme olur ve ışının elektrik alanı ile etkileşebilecek bir alan meydana gelir. Işının frekansı molekülün doğal titreşim frekansına uyarsa, moleküler titreşim genliğinde bir değişme meydana getiren net bir enerji alışverişi gerçekleşir; bu da ışının absorpsiyonu demektir.
Raman Spektroskopisi
Raman Saçılımı
Raman saçılımı (en:Raman Scattering) Hint fizikçi C. V. Raman tarafından 1928 yılında bulundu. Raman’a göre;
- Işın geçirgen bir ortamdan geçerken, ortamdaki türler gelen ışın demetinin bir kısmını çeşitli yönlere doğru saçarlar. Raman saçılmasının diğer saçılma türlerinden farkı saçılan ışının bir bölümünün kuvantlaşmış frekans değişimlerine uğramasıdır. Bu değişimler, polarisasyon süreci sonunda moleküllerdeki titreşim enerji geçişleriyle meydana gelirler.
- Yayınlanan ışın üç tiptir: Stokes saçılımı, Anti-Stokes saçılımı ve Rayleigh saçılımı. Rayleigh saçılımının dalga boyu uyarıcı kaynağın dalga boyuyla tamamen aynı olup bu saçılım diğer iki tipten belirgin bir şekilde daha şiddetlidir.
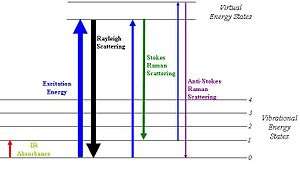
Şekil 4. Işın saçılımları; Rayleigh, Stokes ve Anti-Stokes
Raman aktif moleküller
Bir titreşimin Raman aktif olabilmesi için, molekülün kutuplaşabilirliğinin titreşimsel hareket sırasında değişim göstermesi gerekir.
İzotop etkisi
İzotop bağlamaları genellikle bazı titreşimsel modların tanımlanmasında kullanılır. Spektrumlardaki tanımlanmamış pikleri çoğu zaman izotop bağlamaları kanıtlar.
Hooke Kanunu
Hooke kanunundan geliştirelen (en:Hooke's Law) kütle ile frekans arasındaki ilişki aşağıdaki gibidir.
Burada v=frekans, k= kuvvet sabiti ve μ= indirgenmiş kütle olup aşağıdaki formülle hesaplanır.
1/μ=1/m1+1/m2
m1 ve m2 ise bağı oluşturan atomların kütleleridir.
Su molekülüne göre bu bağıntıyı ispat edecek olursak;
H2O için; m1 = 1g/mol ve m2 =16g/mol hesaplanan indirgenmiş kütle değeri; μ= 0.94g/mol
D20 (ağır su) için; m1 = 2g/mol ve m2 =16g/mol μ=1.78g/mol
Bu iki molekülün frekans denklemlerini oranlarsak;
ƲD/ ƲH = √ μ H / √ μ D
Frekansın indirgenmiş kütlenin karekökü ile ters orantılı olduğunu görürüz.
ƲD/ ƲH =0.73
O-H gerilmesinin frekansı 3200 cm−1 olduğunu bildiğimizden O-D gerilmesinin frekansını yukarıdaki denklemden hesaplayabiliriz ki bu değer 2336 cm-1 ye eşittir. (Bknz. Şekil 5)
Bu hesaplamalarda da göründüğü üzere izotop kullanımı ile tanımlamak istediğimiz molekülü spektrumda görülen kayma ile tanımlayabiliriz. (en:isotope shift)
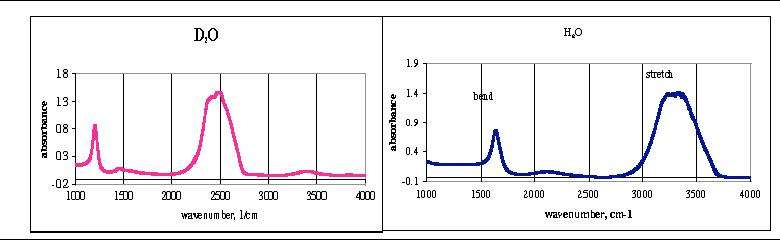
Şekil 5. Su ve ağır suyun infrared spektrumları.
Kaynakça
- Serway Fizik II
- Enstrümental Analiz, Skoog, Holler, Nieman Bilim Yayıncılık
- http://www.rsc.org/csr, Vibrational Spectroscopy: a “vanishing” discipline?, Robert J. Meier, 26.05.2005
- http://science.widener.edu/svb/ftir/ir_co2.html
- http://www.med.upenn.edu/bmbgrad/Faculty/Master_List/Vanderkooi/course_notes/8.vibrational.pdf