Amonyum nitrat
| Amonyum nitrat | |
|---|---|
 | |
 | |
 | |
| Amonyum nitrat | |
| Tanımlayıcılar | |
| CAS numarası | 6484-52-2 |
| RTECS numarası | BR9050000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 21511 |
| Özellikler | |
| Molekül formülü | (NH4)(NO3) |
| Molar kütle | 80.052 gr/mol |
| Görünüm | beyaz/gri katı |
| Yoğunluk | 1.725 gr/cm3 (20 °C) |
| Erime noktası |
169.6 °C |
| Kaynama noktası |
yaklaşık 210 °C’parçalanır |
| Çözünürlük (su içinde) | 118 gr/100 ml (0 °C) 150 gr/100 ml (20 °C) 297 gr/100 ml (40 °C) 410 gr/100 ml (60 °C) 576 gr/100 ml (80 °C) 1024 gr/100 ml (100 °C)[1] |
| Tehlikeler | |
| Ana tehlikeler | Patlayıcı |
| NFPA 704 |
 0
2
3
|
| LD50 | 2085–5300 mg/kg (sıçan ve farelerde oral doz)[2][3] |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
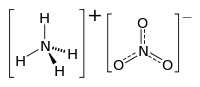
Amonyum nitrat, kimyasal formülü NH4NO3 olan bir azotlu bileşiktir. Bileşik, bir amonyum ve bir nitrat kökünün bileşik oluşturmasıyla elde edilir. En bilinen kullanım alanı tarımsal gübrelemedir. Aynı zamanda güçlü bir patlayıcıdır.
Üretim
Amonyum nitratın üretimi sanayide oldukça basittir. Amonyak molekülü ile nitrik asit gibi güçlü bir asit bileşiğe sokularak amonyum nitrat elde edilir:
- NH3 + HNO3 → NH4NO3
Ayrıca bakınız
Kaynakça
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. s. 362. ISBN 1-903996-65-1.
- ↑ http://www.ehs.neu.edu/laboratory_safety/general_information/nfpa_hazard_rating/documents/NFPAratingAC.htm
This article is issued from Vikipedi - version of the 12/4/2016. The text is available under the Creative Commons Attribution/Share Alike but additional terms may apply for the media files.