Fransiyum
| ||||||||||||||||||||||||||||
| Genel | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Adı, Sembolü, Atom numarası | Fransiyum, Fr, 87 | |||||||||||||||||||||||||||
| Element serisi | Alkali metaller | |||||||||||||||||||||||||||
| grup, periyot, blok | 1, 7, s | |||||||||||||||||||||||||||
| Görünüş | Metalik | |||||||||||||||||||||||||||
| Atom ağırlığı | (223) g·mol−1 | |||||||||||||||||||||||||||
| Elektron dizilimi | [Rn] 7s1 | |||||||||||||||||||||||||||
| Enerji seviyesi başına Elektronlar | 2, 8, 18, 32, 18, 8, 1 | |||||||||||||||||||||||||||
| Fiziksel özellikleri | ||||||||||||||||||||||||||||
| Maddenin hali | ? katı | |||||||||||||||||||||||||||
| Yoğunluk (o.s.) | 1,87 g·cm−3 | |||||||||||||||||||||||||||
| Erime noktası | ? 300 K 27 °C, 80 °F) | |||||||||||||||||||||||||||
| Kaynama noktası | ? 950 K ? 677 °C, ? 1250 °F) | |||||||||||||||||||||||||||
| Ergime ısısı | ca. 2 kJ·mol−1 | |||||||||||||||||||||||||||
| Buharlaşma ısısı | ca. 65 kJ·mol−1 | |||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Atom özellikleri | ||||||||||||||||||||||||||||
| Kristal yapısı | ? Cisim merkezli kübik | |||||||||||||||||||||||||||
| Yükseltgenme seviyesi | 1 | |||||||||||||||||||||||||||
| Elektronegatifliği | 0,7 (Pauling ölçeği)< | |||||||||||||||||||||||||||
| İyonlaşma enerjileri | 1.: 380 kJ/mol | |||||||||||||||||||||||||||
| Diğer özellikleri | ||||||||||||||||||||||||||||
| Isıl iletkenlik | (300 K) ? 15 W·m−1·K−1 | |||||||||||||||||||||||||||
| CAS kayıt numarası | 7440-73-5 | |||||||||||||||||||||||||||
| Özdirenç | ? 3 µΩ·m | |||||||||||||||||||||||||||
| Seçilmiş izotoplar | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Fransiyum, (keşfedilmeden önceki teorik adıyla eka-sezyum veya aktinyum K[1]) sembolü Fr ve atom numarası 87 olan kimyasal element. Bilinen elementler içinde en az elektronegatifliğe sahip olan ve astatinden sonra doğada en az bulunan elementtir. Astatin, radyum ve radona bozunan fransiyumun radyoaktivitesi son derece yüksektir. Bir alkali metal olarak bir tane değerlik elektronuna sahiptir.
Fransiyum Marguerite Perey tarafından 1939'da ismini aldığı Fransa'da keşfedildi. Sentezlenmeden doğada keşfedilen son elementtir.[2] Fransiyum laboratuvar dışında son derece az bulunur, fransiyum-223 izotopunun devamlı olarak oluşup bozunduğu uranyum ve toryum cevherlerinde eser miktardadır. Herhangi bir zamanda yerkabuğunda bu izotoptan 30 gram (1 ons) gibi az bir miktarda bulunur; diğer izotopların tamamı sentetik olarak elde edilir. Şimdiye kadar herhangi bir izotoptan toplanan en büyük miktar 1997'de Stony Brook Üniversitesi'nde ultrasoğuk gaz olarak yaratılan 10.000 fransiyum-210 atomunun oluşturduğu, yani yaklaşık 3.5x10−18 gramlık kümedir.[3].
Özellikleri
Fransiyum, 106 atom numaralı seaborgiyumdan hafif olan elementler içinde en karasız olanıdır;[3] fransiyumun en kararlı izotopu 22 dakikadan daha kısa yarı ömrü olan fransiyum-223'tür. Doğal olarak bulunan elementler içinde kararsızlıkta ikinci sırada bulunan astatinin en kararlı izotopunun yarı ömrü 8,3 saattir.[4] Fransiyumun bütün izotopları astatin, radyum ya da radona bozunabilirler.[5]
Fransiyumun kimyasal özellikleri diğer alkali metaller arasından en çok sezyumunkine benzer.[3] Oldukça ağırdır ve eşdeğer ağırlığı en yüksek elementtir.[3] Bilinen elementler içinde (pauling ölçeğine göre) 0,7 değeri ile en düşük elektronegatifliğe sahip elementtir;[6] sezyum 0,79 ile ikinci en düşük elektronegatifliğe sahiptir.[7] Eğer elde edilebilseydi sıvı fransiyumun erime noktasındaki yüzey gerilimi 0,05092 N/m olurdu.[8] Fransiyum birkaç sezyum tuzu ile kopresipitasyon (beraber çökeltme) gerçekleştirebilir. Örneğin sezyum perklorat ile gerçekleşen kopresipitasyonun sonucu az miktarda fransiyum perklorattır. Bu kopresipitasyon, Glendenin ve Nelson'ın radyosezyum kopresipitasyon metodunun adapte edilmesiyle fransiyumun izole edilebilmesi için kullanılabilir. Fransiyum ek olarak iyodat, pikrat, tartarat (rubidyum tartarat), platinklorür ve silikotungsten gibi diğer birçok sezyum tuzu ile de kopresipitasyon gerçekleştirebilecektir. Element ayrıca, farklı bir ayrıştırma metodu sağlayan, taşıyıcı herhangi bir alkali metal olmadan tungosilik asit ve perklorik asit ile de kopresipitasyon gerçekleştirebilir.[9][10] Nerdeyse bütün fransiyum tuzları suda çözünebilirler.[11]
Kullanım
Fransiyum, kararsızlığı ve nadir bulunuşu[12][13][14][15][16] nedeniyle ticari amaçlı kullanılmaz. Element biyoloji ve atomik yapı alanlarında araştırma amaçlı kullanılır. Fransiyumun kanserle ilişkili hastalıkların teşhisinde kullanılabileceği düşünülüyordu, buna rağmen sonrasında varılan sonuç bu uygulamanın pratik olmadığı yönündedir.[5][14]
Sentezlenebilmesi, tuzaklanabilmesi, soğutulabilmesi ve görece basit atomik yapısı ile fransiyum gelişmiş spektroskopi deneylerinde kulanılır. Bu deneyler enerji seviyeleri hakkındaki özel bilgilerin ve atomaltı parçacıklar arasındaki eşleşme sabitinin elde edilmesini sağladı.[17] Lazerle tuzaklanan fransiyum iyonları üzerindeki çalışmalar atomik enerji seviyeleri arasındaki geçişler hakkında kuantum teorisinin öngörüsüne benzer şekilde kesin bilgiler sağladı.[18]
Tarih
1870'lerde kimyagerler sezyumun ötesinde 87 atom numaralı bir alkali metal olması gerektiğini düşünüyorlardı.[5] Bu element eka-sezyum olan geçici bir isimle anıldı.[19] Araştırma ekipleri bu kayıp elementi saptayıp izole etmeyi denediler. Gerçek bir keşif yapılmadan önce, en az dört kez elementin bulunduğuna dair yanlış iddia ortaya atıldı.
Hatalı ve eksik keşifler
Rus kimyager D. K. Dobroserdov eka-sezyum ya da fransiyumu keşfettiğini iddia eden ilk bilim insanıydı. 1925'te, başka bir alkali metal olan potasyumun bir numunesinde zayıf radyoaktivite gözlemledi. Buradan eka-sezyumun örnekte radyoaktif kontaminasyona (radyoaktif kirlenme) sebep olduğu sonucunu çıkardı.[20] Sonrasında kendi ülkesine atfen russium adını verdiği eka-sezyumun özellikleri ile ilgili öngörülerini içeren bir tez yayımladı.[21] Kısa bir süre sonra Odessa Dobroserdov Politeknik Enstitüsü'ndeki öğretmenlik kariyerine odaklanıp elementle ilgili çalışmalarını daha fazla devam ettirmedi.[20]
Takip eden yılda İngiliz kimyagerler Gerald J. F. Druce ve Frederick H. Loring, mangan(II) sülfat fotoğraflarının x-ışını analizini yaptılar.[21] Druce ve Loring eka-sezyuma ait olabileceğini öngördükleri spektral çizgileri gözlemlediler. Sonrasında element 87'yi keşfettiklerini açıkladılar ve en ağır alkali metal olan bu element için alkalinium ismini teklif ettiler.[20]
1930'da Alabama Politeknik Enstitüsü'nden Fred Allison, manyeto optik makinesiyle polüsit ve lepidolit minerallerini incelerken element 87'yi keşfettiğini iddia etti. Elemente kendi eyaleti Virginia'ya atfen virginium isminin verilmesini ve sembol olarak da Vi veya Vm'yi önerdi.[21][22] 1934'te UC Berkeley'den H.G. MacPherson, Allison'un kullandığı yöntemin geçerliliğini ve keşfin doğruluğunu çürüttü.[23]
1936'da Rumen kimyager Horia Hulubei ve Fransız meslektaşı Yvette Cauchois de polüsit incelemesi yaptı. İnceleme bu kez yüksek çözünürlüklü X-ray cihazı ile yapıldı.[20] İnceleme sırasında element 87'ye ait olduğunu sandıkları birçok emisyon çizgisi gözlemlediler. Hulubei ve Cauchois keşiflerini rapor ettiler ve element için çalışmalarını tamamladıkları Romanya'nın Moldavia iline atfen moldavium ismini ve Ml sembolünü önerdiler.[21] 1937'de Hulubei'in araştırma metodunu reddeden ABD'li fizikçi F. H. Hirsh Jr. çalışmayı eleştirdi. Eka-sezyumun doğal olarak bulunamayacağından emin olan Hirsh, Hulubei'in civa veya bizmut atomunun x-ışını çizgilerini gözlemlemiş olabileceğini söyledi. Ancak Hulubei kullandığı x-ışını cihazının böyle bir hata yapamayacak kadar hassas olduğu konusunda ısrar etti. Nobel Ödülü sahibi ve Hulubei'in akıl hocası olan Jean Baptiste Perrin, Marguerite Perey'nin yeni keşfi fransiyuma karşı gerçek eka-sezyum olarak moldaviumu destekledi. Perey, kendisinin element 87'nin tek kaşifi olduğu onaylanıncaya kadar Hulubei'in çalışmasını eleştirmeye devam etti.[20]
Perey'nin analizi
Eka-sezyum 1939'da Paris, Fransa'daki Curie Enstitüsü'nde Marguerite Perey tarafından, bozunma enerjisi 220 keV olarak rapor edilen aktinyum-227'nin saflaştırılması sırasında keşfedildi. Yine de Perey enerji seviyesi 80 keV'in altında bulunan bozunum parçacıkları olduğunu farketti. Perey bu bozunum aktivitesine daha önce tanımlanmamış bir bozunum ürününün sebep olabileceğini düşündü. Bu ürün saflaştırma esnasında ayrılıyor ama saf aktinyum-227'nin dışında tekrar ortaya çıkıyordu. Yapılan çeşitli testler bilinmeyen elementin toryum, radyum, kurşun, bizmut veya talyum olma olasılığını ortadan kaldırdı. Yeni ürün alkali metallerin kimyasal özelliklerini gösteriyordu. Bu özellik Perey'nin bu ürünün aktinyum-227'nin alfa bozunumu yapması sonucu ortaya çıkan element 87 olduğuna inanmasına yol açtı.[19] Perey daha sonra aktinyum-227'nin beta bozunumunun alfa bozunumuna oranını belirlemeyi denedi. Onun yaptığı ilk test alfa bozunumunun %0,6'ya uzandığını gösterdi, daha sonraki inceleme %1 sonucunu verdi.[24]
Perey yeni izotopu aktinyum-K (fransiyum-223)[19] olarak isimlendirdi. Ardından 1946'da en elektropozitif katyon olduğuna inandığı bu element için catium ismini önerdi. Perey'nin danışmanlarından biri olan Nobel Ödülü sahibi bilim insanı Irène Joliot-Curie katyondan (cation) daha çok kediyi (cat) çağrıştırdığını söyleyerek bu isme karşı çıktı.[19] Sonrasında Perey Fransa'ya atfen fransiyum ismini teklif etti. Galyumdan sonra ismi Fransa'ya atfedilen ikinci element olan fransiyum 1946'da Uluslararası Temel ve Uygulamalı Kimya Birliği (International Union of Pure and Applied Chemistry - IUPAC) tarafından resmen benimsendi.[5] Simge olarak Fa seçildi kısa bir süre sonra da Bertrand Goldschmidt'in önerisi ile simge Fr olarak değiştirildi.[25] Fransiyum doğal olarak bulunan elementler içinde en son keşfedilendir.[19] Fransiyumun yapısı ile ilgili daha sonraki araştırmaları 1970'lerde ve 1980'lerde CERN'de Sylvain Lieberman ve ekibi yaptı.[26]
Bulunuşu
Doğal
Fransiyum-223, aktinyum-227'nin alfa bozunumu yapması sonucu oluşur ve toryum ile uranyum minerallerinde eser miktarda bulunur.[3] Verilen bir uranyum numunesinde her 1×1018 uranyum atomuna karşın yaklaşık olarak sadece 1 tane fransiyum atomu vardır.[14] Ayrıca yeryüzü üzerinde herhangi bir anda toplam olarak en fazla 30 g kadar fransiyum bulunduğu hesaplanmıştır.[27] Bu özelliği ile fransiyum astatinden sonra yer kabuğunda en nadir bulunan elementtir.[5][14]
Sentezi
Fransiyum 197Au + 18O → 210Fr + 5n nükleer reaksiyonunda sentezlenebilir. Bu işlem 209, 210 ve 211 kütleli fransiyum izotopu ürünleriyle Stony Brook Physics'de geliştirildi.[28] Ardından ürünler manyeto optik tuzak (MOT) tarafından izole edildi.[29] Diğer sentezleme metodları ise radyumun nötron ile bombardıman edilmesi ve toryumun proton, döteronlar ya da helyum iyonları ile bombardıman edilmesidir.[24] 2006 itibarı ile henüz tartılabilinecek yeterlilikte fransiyum sentezlenemedi.[3][5][14][30]
İzotopları
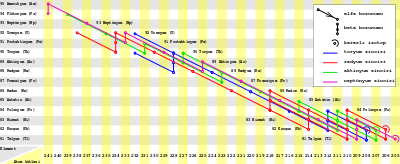
Fransiyumun atomik kütleleri 199 ile 232 arasında değişen 34 tane izotopu vardır.[3] Fransiyum yedi tane yarı kararlı nükleer izomere sahiptir.[3] Sadece fransiyum-223 ve fransiyum-221 doğada bulunur.[31]
Fransiyum-223, 21,8 dakikalık yarı ömrü ile en kararlı izotoptur,[3] daha uzun yarı ömre sahip bir fransiyum izotopunun keşfedilmesi veya sentezlenmesi olası görünmüyor.[24] Aktinyum 227'nin kız ürünü olan fransiyum-223 aktinyum bozunma serisinin beşinci ürünüdür.[16] Fransiyum-223 beta bozunumu sonucunda radyum-223'e dönüşür (1149 keV bozunma enerjisi), küçük (0,006%) bir alfa bozunumu ile astatin-219'a dönüşür (5,4 MeV bozunma enerjisi).[32]
Fransiyum-221, 4,8 dakikalık bir yarı ömre sahiptir.[3] Aktinyum-225'in kız ürünü olarak fransiyum-221 neptünyum bozunma serisinin dokuzuncu ürünüdür.[16] Fransiyum-221 alfa bozunumu (6,457 MeV bozunum enerjisi) yolu ile astatin-217'ye dönüşür.[3]
En az kararlı temel düzey izotopu 0,12 μs'lik yarı ömrü ile fransiyum-215'tir.[3] Bu izotopun yarı kararlı izomeri fransiyum-215m yine de sadece 3,5 ns olan yarı ömrü ile daha az kararlıdır.[33]
Kaynakça
- ↑ En kararlı izotopu; Fr-223
- ↑ Teknesyum gibi bazı sentetik elementler daha sonra doğada da bulunmuşlardır.
- 1 2 3 4 5 6 7 8 9 10 11 12 CRC Handbook of Chemistry and Physics, 4, CRC, 2006, ss. 12, 0-8493-0474-1
- ↑ http://www.webelements.com/astatine/
- 1 2 3 4 5 6 Price, Andy (2004-12-20). "Francium". 20 Eylül 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150920162142/http://www.andyscouse.com/pages/francium.htm. Erişim tarihi: 2007-03-25.
- ↑ Pauling, Linus (1960). The Nature of the Chemical Bond (3rd Edn.). Cornell University Press. s. 93.
- ↑ Winter, Mark. "Electronegativies". Caesium. The University of Sheffield. 21 Mayıs 2008 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20080521160529/http://www.webelements.com/webelements/elements/text/Cs/eneg.html. Erişim tarihi: 2007-05-09. Pauling places caesium and francium with the same electronegativity.
- ↑ Kozhitov, L. V.; Kol'tsov, V. B., and Kol'tsov, A. V. (2003-02-21). "Evaluation of the Surface Tension of Liquid Francium". Inorganic Materials (Springer Science & Business Media B.V.) 39 (11): 1138–1141. DOI:10.1023/A:1027389223381. http://search.ebscohost.com/login.aspx?direct=true&db=aqh&AN=16822434&site=ehost-live. Erişim tarihi: 14 Nisan 2007.
- ↑ Hyde, E. K. (1952). "Radiochemical Methods for the Isolation of Element 87 (Francium)". J. Am. Chem. Soc. 74 (16): 4181–4184. DOI:10.1021/ja01136a066.
- ↑ E. N K. Hyde Radiochemistry of Francium,Subcommittee on Radiochemistry, National Academy of Sciences-National Research Council; available from the Office of Technical Services, Dept. of Commerce, 1960.
- ↑ A. G. Maddock. Radioactivity of the heavy elements. Q. Rev., Chem. Soc., 1951, 3, 270–314. DOI:10.1039/QR9510500270
- ↑ Winter, Mark. "Uses". Francium. The University of Sheffield. 6 Eylül 2008 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20080906113514/http://www.webelements.com/webelements/elements/text/Fr/uses.html.
- ↑ Bentor, Yinon. "Chemical Element.com - Francium". 17 Mayıs 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150517064116/http://www.chemicalelements.com:80/elements/fr.html. Erişim tarihi: 2007-03-25.
- 1 2 3 4 5 6 Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. s. 151–153. ISBN 0-19-850341-5.
- ↑ Gagnon, Steve. "Francium". Jefferson Science Associates, LLC. 10 Mart 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150310160738/http://education.jlab.org:80/itselemental/ele087.html. Erişim tarihi: 2007-04-01.
- 1 2 3 Considine, Glenn D., ed. (2005), "Chemical Elements", Van Nostrand's Encyclopedia of Chemistry, New York: Wylie-Interscience, ss. 332, ISBN 0-471-61525-0
- ↑ Gomez, E; Orozco, L A, and Sprouse, G D (7 Kasım 2005). "Spectroscopy with trapped francium: advances and perspectives for weak interaction studies". Rep. Prog. Phys. 69 (1): 79–118. DOI:10.1088/0034-4885/69/1/R02. http://www.iop.org/EJ/abstract/0034-4885/69/1/R02/. Erişim tarihi: 2007-04-11.
- ↑ Peterson, I (1996-05-11). "Creating, cooling, trapping francium atoms". Science News. s. 294. http://search.ebscohost.com/login.aspx?direct=true&db=ulh&AN=9605167788&site=src-live. Erişim tarihi: 2007-04-11.
- 1 2 3 4 5 Adloff, Jean-Pierre; Kaufman, George B. (2005-09-25). Francium (Atomic Number 87), the Last Discovered Natural Element. The Chemical Educator 10 (5). 2007-03-26 tarihinde erişildi.
- 1 2 3 4 5 Fontani, Marco (2005-09-10). "The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do)". International Conference on the History of Chemistry. Lisbon. ss. 1–8. 2006-02-24 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20060224090117/http://5ichc-portugal.ulusofona.pt/uploads/PaperLong-MarcoFontani.doc. Erişim tarihi: 2007-04-08.
- 1 2 3 4 Van der Krogt, Peter (2006-01-10). "Francium". Elementymology & Elements Multidict. 9 Ocak 2006 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20060109161128/http://www.vanderkroft.net:80/elements/elem/fr.html. Erişim tarihi: 2007-04-08.
- ↑ "Alabamine & Virginium". TIME. 1932-02-15. http://www.time.com/time/magazine/article/0,9171,743159,00.html. Erişim tarihi: 2007-04-01.
- ↑ MacPherson, H. G. (1934-12-21). "An Investigation of the Magneto-Optic Method of Chemical Analysis". Physical Review (American Physical Society) 47 (4): 310–315. DOI:10.1103/PhysRev.47.310. http://prola.aps.org/abstract/PR/v47/i4/p310_1. Erişim tarihi: 2007-04-08.
- 1 2 3 "Francium", McGraw-Hill Encyclopedia of Science & Technology, 7, McGraw-Hill Professional, 2002, ss. 493–494, ISBN 0-07-913665-6
- ↑ Grant, Julius (1969), "Francium", Hackh's Chemical Dictionary, McGraw-Hill, ss. 279–280
- ↑ "History". Francium. SUNY Stony Brook Physics & Astronomy. 2007-02-20. 15 Mayıs 2008 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20080515132357/http://fr.physics.sunysb.edu/francium_news/history.HTM. Erişim tarihi: 2007-03-26.
- ↑ Winter, Mark. "Geological information". Francium. The University of Sheffield. 2 Nisan 2008 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20080402044925/http://www.webelements.com:80/webelements/elements/text/Fr/geol.html. Erişim tarihi: 2007-03-26.
- ↑ "Production of Francium". Francium. SUNY Stony Brook Physics & Astronomy. 2007-02-20. 15 Mayıs 2008 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20080515113341/http://fr.physics.sunysb.edu/francium_news/production.htm. Erişim tarihi: 2007-03-26.
- ↑ "Cooling and Trapping". Francium. SUNY Stony Brook Physics & Astronomy. 2007-02-20. 31 Mayıs 2008 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20080531060115/http://fr.physics.sunysb.edu:80/francium_news/trapping.HTM. Erişim tarihi: 2007-05-01.
- ↑ "Francium". Los Alamos Chemistry Division. 2003-12-15. 23 Kasım 2010 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20101123174904/http://periodic.lanl.gov:80/elements/87.html. Erişim tarihi: 2007-03-29.
- ↑ Considine, Glenn D., ed. (2005), "Francium", Van Nostrand's Encyclopedia of Chemistry, New York: Wylie-Interscience, ss. 679, ISBN 0-471-61525-0
- ↑ National Nuclear Data Center (1990). "Table of Isotopes decay data". Brookhaven National Laboratory. 11 Ocak 2014 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20140111150034/http://ie.lbl.gov/toi/nuclide.asp?iZA=870223. Erişim tarihi: 2007-04-04..
- ↑ National Nuclear Data Center (2003). "Fr Isotopes". Brookhaven National Laboratory. 11 Ocak 2014 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20140111150302/http://ie.lbl.gov/education/parent/Fr_iso.htm. Erişim tarihi: 2007-04-04..
Dış bağlantılar
- (Türkçe) Bilim ve Teknik Dergisi'nde fransiyum
- (İngilizce) Stony Brook Üniversitesi Fizik Bölümü
- (İngilizce) WebElements.com - Fransiyum
- (İngilizce) Los Alamas Ulusal Laboratuvarı - Fransiyum
- (İngilizce) Kenneth Barbalace. Periodic Table of Elements - Fransiyum
- (İngilizce) Berkeley Ulusal Laboratuvarı (ABD) - Fransiyumun izotopları
- (İngilizce)
 Ulusal Araştırma Konseyi (ABD) - Radiochemistry of Francium
Ulusal Araştırma Konseyi (ABD) - Radiochemistry of Francium
| |||||||||||||

