Beta yaprak
Proteinlerin ikincil yapısında β yaprak (β plili yaprak olarak da adlandırılır), alfa sarmaldan sonra en sık görülen biçimdir. Beta yapraklar birbirine en az iki veya üç hidrojen bağı ile yatay bağlanmış beta ipliklerden oluşur, bunlardan plili ve burkulmuş bir yaprak meydana getirir. Bir beta iplik (β iplik olarak da yazılır) 3 ila 10 amino asit uzunluğunda bir polipeptit zincirinden oluşur, polipeptir omurga neredeyse tamamen uzanık (İng. extended) bir konformasyondadır. β yaprakların birleşmesinden kaynaklanan protein yığışımları (agregatlar) ve telcikler (fibriller), çeşitli hastalıkların oluşumunda rol oynar, bunların arasında Alzheimer gibi amiloidoz hastalıkları kayda değerdir.
Adlandırma sistemi
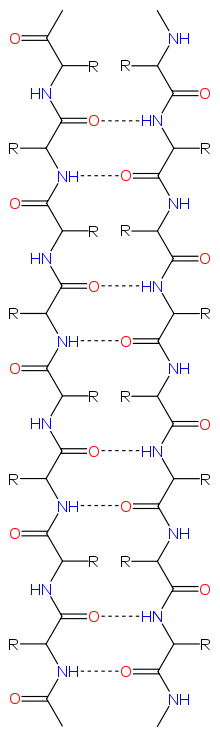
En yaygın kullanımda β iplik terimi, en az bir diğer iplik ile omurga hidrojen bağları oluşturmuş, uzamış konformasyonlu tek bir bitişik polipeptit parçasına karşılık gelir; buna karşın β yaprak birbirine hidrojen bağlı (H-bağlı) en az iki β iplikten oluşmuş toplaşma (İng. assembly) demektir.
Tarih
İlk β yaprak yapısı William Astbury tarafından 1930'larda önerilmiştir. Paralel veya antiparalel uzamış β ipliklerin peptit bağları arasında hidrojen bağlanması kavramını öne sürmüştür. Ancak, hatasız bir model inşa edebilmek için Astbury, amino asitlerin bağ geometrisi hakkında yeterli veriye sahip değildi, özellikle peptit bağının düzlemsel olduğunu bilmiyordu. Ayrıntılandırılmış bir model 1951'de Linus Pauling ve Robert Corey tarafından önerildi.
Yapı ve doğrultu
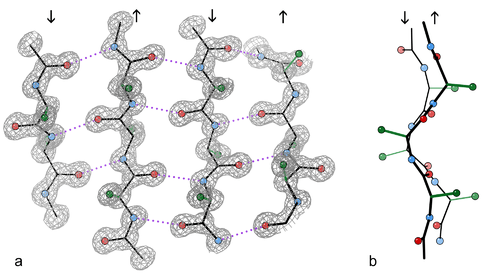
 Bir antiparalel beta yaprakta, noktalı çizgilerle gösterilmiş hidrojen bağları. |  Bir antiparalel beta yaprakta, noktalı çizgilerle gösterilmiş hidrojen bağları. Oksijen atomları kırmızı, azot atomları mavidir. |
Geometri
β yaprakların çoğu, diğer yapraklara bitişiktir ve komşularıyla yaygın bir hidrojen bağ ağı meydana getirirler. Bu ağda, bir ipliğin omurgasındaki N-H grupları bitişik bir ipliğin omurgasındaki C=O grupları arasındaki hidrojen bağlarından oluşur. Tamamen düzleştirilmiş β yaprakta, ardışık amino asit yan grupları yukarı, sonra aşağı, sonra yukarı, vb. doğrultulu olurlar. Bir β yapraktaki bitişik β ipliklerin α atomları bitişiktir ve yan zincirler aynı yöne işaret edecek şekilde hizalıdır. β ipliklerin "plili" görünümü Cα atomundaki tetrahedral kimyasal bağlardan meydana gelir; örneğin, eğer bir yan zincir yukarı yönelmişse atomuna olan bağ aşağı olmalıdır, çünkü bağ açısı yaklaşık 109,5°'dır. Pli oluşumu ile arasındaki uzaklığın yaklaşık 6 Å olmasına neden olur, trans konformasyonunda tamamen uzatılmış iki peptit bağındaki 7,6 Å (2 × 3,8 Å) uzaklığı yerine. Hidrojen bağlı β ipliklerde iki bitişik Cα atomu arasındaki "yanlamasına" mesafe yaklaşık 5 Å'dır.
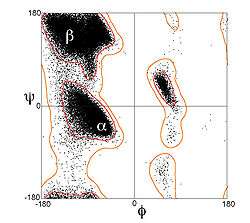
Ancak, β iplikler ender olarak tamamen uzanıktır; kendilerini oluşturan amino asitlerin kiralliği nedeniyle bir burkulma gösterirler. (φ, ψ) = (–135°, 135°) civarındak enerjetik olarak tercihli olan dihedral açılar (Ramachandran çiziminin kabaca üst sol bölgesi), tamamen uzanık konformasyona karşılık gelen (φ, ψ) = (–180°, 180°)'den büyük oranda farklılık gösterir.[1] Burkulma genelde dihedral açı değerlerinin almaşık değişim göstermesi ile ilişkilidir, bu sayede büyük bir yaprak içindeki bireysel β iplikler birbirinden ayrışmaz. Kuvvetle burkulmuş bir β yaprak örneği BPTI proteininde görülebilir. Yan zincirler plilerin katlarından dışarı doğru uzanırlar, yaprak düzlemine yaklaşık dik olarak; ardışık amino asit kalıntıları yaprağın almaşık yüzlerine doğru uzanırlar.
Hidrojen bağı örüntüleri
Peptit zincirleri, N-uç ve C-uçlarına sahip olduklarından yönlüdürler, bundan dolayı β yaprakların da yönlü olduğu söylenebilir. Genelde protein topoloji çizimlerinde C-ucuna doğru bir ok ile gösterilirler. Bitişik β iplikler antiparalel, paralel veya karışık düzenli hidrojen bağları oluşturabilir.
Antiparalel düzende, birbirini izleyen β iplikler ters yönlüdür, öyle ki bir ipliğin ucu öbürünün C-ucuna bitişiktir. Bu düzen, en kuvvetli iplik arası stabiliteyi meydana getirir, çünkü karboniller ve aminler arasındaki iplik arası hidrojen bağlar düzlemsel olur, bu da onların tercihli doğrultusudur. Antiparalel yapraklarda peptit omurgasının dihedral açıları (φ, ψ) yaklaşık (–140°, 135°)'dir. Bu durumda iki atom ve birbirine hidrojen bağlı iki β iplikte birbirlerine bitişikseler, birbirlerinin peptit grupları ile karşılıklı hidrojen bağları oluştururlar; bu, yakın çiftli hidrojen bağları olarak adlandırılır.
Paralel düzende, birbirini izleyen β iplikler aynı yönlüdür; bu doğrultu biraz daha az stabildir çünkü iplikler arası hidrojen bağı örüntüsünün eşdüzlemli olmamasına neden olur. Paralel yapraklarda (φ, ψ) dihedral açıları yaklaşık (–120°, 115°)'dir. Bir motifte birbiriyle etkileşimli beşten az sayıda paralel iplik olması enderdir, muhtemelen daha az sayıda iplikler stabil olmadığı için. Ama, bir diğer neden, paralel β-yaprakların oluşması da temelde daha olmasıdır, çünkü N ve C uçları birbiri ile hizalanmış olan iplikler dizi içinde birbirlerinden uzakta olmak zorundadır. Paralel β-yaprakların daha stabil olabileceğine dair kanıtlar da mevcuttur, çünkü küçük amiloid diziler paralel β-ipliklerden oluşan β-yaprak fibrilleri olarak yığışır, oysa anti-paralel daha stabil olsa anti-paralel fibrillerin oluşması beklenirdi.
Paralel β-yaprak yapılarda iki atom ve birbirine hidrojen bağlı iki β iplikte bitişikseler, birbirleiyle hidrojen bağı kurmazlar. Bir amino asit kalıntısı öbürünü çevreleyen kalıntılarla hidrojen bağları kurar ama bunun tersi olmaz. Örneğin, kalıntı , kalıntı ve ile hidrojen bağları kurabilir. Bunlar, geniş çiftli hidrojen bağları olarak adlandırılır. Buna karşılık, kalıntısı tamamen farklı kalıntılarla hidrojen bağ kurabilir veya hiçbir başka kalıntı ile bağ kurmayabilir de.
Bir iplik, karışık bağlanma düzeni de gösterebilir, bir tarafında paralel iplik, öbürü tarafında antiparalel iplik olabilir. Beta ipliklerin rastgele dağılması varsayımından beklenecek sıklıktan daha ender olarak bu gibi düzenler görülür, bu yüzden bu düzenin anti-paralel düzenden daha az stabil olduğu öne sürülmüştür. Ancak biyoenformatik analizlerle yapısal termodinamik hakkında çıkarımlar yapmak sorunludur, çünkü proteinlerde başka yapısal özellikler de vardır. Ayrıca, protein yapısı hem katlanma kinetiği hem de katlanma termodinamiği tarafından belirlenir, bu yüzden biyoenformatik analizlere dayanarak stabilite çıkarımları yapmakta dikatli olmak gerekir.
β ipliklerin hidrojen bağları mükemmel olmayabilir, beta yumru olarak adlandırılan yerel bozukluklar gösterebilirler.
Hidrojen bağları yaprak düzlemi düzlemi içinde yer alır, peptit karbonil grupları birbirini izleyen amino asit kalıntılarında ters yönlere dönük olurlar; buna karşılık, alfa sarmalda birbirini izleyen karboniller aynı doğrultudadır.
Amino asit eğilimleri
Büyük aromatik kalıntılar (Tyr, Phe ve Trp) ve β-dallı amino asitler (Thr, Val, Ile) β yaprakların ortasındaki β ipliklerde bulunma eğilimindedir. Bazı kalıntılar (Pro gibi) β yaprakların kenarlarında bulunur, muhtemelen yığışma ve amiloid oluşumuna neden olabilecek, proteinler arasında "kenar-kenara" birleşme olmasının önüne geçmek için.[2] Paralel β-yapraklarda dipol momentler bazı kalıntıların (Lys ve Arg gibi) bu yapıya başlık olma eğilimine etki edebileceği öne sürülmüştür.[3] Peptitlerde dipol C-uçtan (kısmen negatif) N-uca (kısmen pozitif) uzanır.
Yaygın yapısal motifler
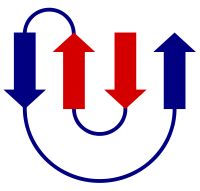
β yapraklarla ilgili çok basit bir yapısal motif beta firketedir. Bu motifte iki antiparalel iplik, iki ilâ beş amino asit kalıntısından oluşan kısa bir ilmikle birbirine bağlıdır. İlmikte genelde bir glisin veya prolin kalıntısı bulunur, her ikisi de sıkı bir dönüş yapmak için olağandışı dihedral açı konformasyonlarına girebilirler. Ancak, β iplikleri daha karmaşık yollarla da, örneğin alfa sarmal içeren uzun halkalar, hatta bütün protein bölgeleri ile birbirine bağlanabilir.
Yunan anahtar motifi
Yunan anahtar motifi dört bitişik antiparalel iplikten ve onları birleştirici ilmiklerden oluşur. Firketelerle bağlı üç antiparalel iplik vardır. Dördüncü iplik birinciye yanında yer alır ve üçüncüye uzun bir ilmikle bağlıdır. Bu tip yapı protein katlanma sürecinde kolaylıkla oluşur.[4][5] Bu motif, antik Yunan dekorasyon sanatında görülen bir biçime atfen adlandırılmıştır (bakınız menderes (sanat)).
β-α-β motifi
Kendilerini oluşturan amino asitlerin kiralliği nedeniyle, tüm ipliklerde, üst düzey β yaprak yapılarında belli olan, bir "sağ-elli" burkulma vardır. Özellikle, iki paralel iplik arasındaki birleştirici ilmik hemen hep bir sağ-elli bir krosover kirallığı gösterir, yaprağın doğasında olan burkulma bu özelliği kuvvetle destekler. Bu birleştirici ilmik sıklıkla bir sarmal bölge içerir, böyle durumlarda bu biçim β-α-β motifi olarak adlandırılır. Bununla yakından ilişkili bir motif olan β-α-β-α motifi, sık görülen protein üçüncül yapısı olan TIM fıçısının temel bileşenidir.

Fare monoklonal antikoru ile kompleksleşmiş Borrelia burgdorferi Protein A'sının dış yüzeyinin bir kısmı
β-menderes motifi
Bir firkete ilmik ile birleştirilmiş 2 veya daha çok ardışık antiparalel β-iplikten oluşmuş bir basit süperikincil protein topolojisi.[6][7] Bu motif β-yapraklarda sıkça görülür. β-fıçı ve β-pervane dahil çeşitli yapı mimarilerinde bulunabilir.

Karboksipeptidaz A'nın bir bölümü.
Psi-ilmik motifi
Psi ilmik (Ψ-ilmik) motifi, iki antiparalel iplikten oluşur, bunlar her iki ikisine de hidrojen bağları ile bağlı bir iplik ile birleştirilmiştir.[8] Tek Ψ-ilmikleri için dört olası iplik topolojisi vardır. Bu motif enderdir cünkü onun oluşuna yol açan sürecin, protein katlanması sırasında meydana gelmesi düşük olasılıklıdır. Ψ-ilmik ilk defa aspartik proteaz ailesinde tespit edilmiştir.[9]
Beta yapraklı proteinlerin yapısal mimarileri
Beta yapraklar tüm-β (İng. all-β) , α+β ve α/β bölgelerinde bulunurlar, SCOP protein sınıflandırma sistemine göre, ayrıca genel mimaridi iyi tanımlanmamış pek çok peptit ve küçük proteinde bulunur. tüm-β bölgeler β fıçı, β sandviç, β pervane ve β-sarmallar oluşturabilir
Yapısal topoloji
Bir β yaprağın topolojisi, protein omurgası boyunca hidrojen bağlı β ipliklerin sırasını belirtir. Örneğin, flavodoksin katlaması 21345 topolojili, beş iplikli, paralel β yapraktan oluşur. Yani, kenar iplikler omurga üzerindeki 2. ve 5. β ipliklerdir. Daha açık olarak, β iplik 2, β iplik 1 ile H-bağlıdır, o da β iplik 3 ile H-bağlıdır, o da β iplik 4 ile H-bağlıdır, o da β iplik 5 ile. Bu sonuncusu β yaprağın öbür kenarını oluşturur. Aynı sisteme göre, yukarıda belirtilen Yunan anahtar motifi 4123 topolojisine sahiptir. Bir β yaprağın ikincil yapısı kabaca ipliklerin sayısı, onların topolojisi ve hidrojen bağlarının paralel mi anti paralel mi olduğu ile belirtilebilir.
β yapraklar açık olabilir, yani iki kenar iplikçiğe sahip olabilirler (flavodoxin katlaması veya immünoglobin katlamasında olduğu gibi) veya kapalı beta fıçı olabilirler (TIM fıçısı gibi). β-Fıçılar genelde dekalaj veya kaymaları ile tarif edilir. Bazı açık β yapraklar çok kavislidir ve kendileri üzerine katlanırlar (SH3 bölgesinde olduğu gibi) veya atnalı şekli oluşturabilirler (ribonükleaz katlamasında olduğu gibi). Açık β yapraklar yüz-yüze (beta-pervane bölgesi veya immünoglobin katlaması gibi) veya kenar-kenara birleşip büyük bir β yaprak meydana getirebilir.
Dinamik özellikler
Proteinlerdeki beta-yapraklar Raman spektrometresi ile gözlemlendiklerinde akordeon gibi, düşük frekanslı hareket gösterirler.[10][11]
Paralel β sarmallar

Bir β sarmal birbirine kısa ilmiklerle bağlı, iki veya üç kısa β iplikten oluşan, tekrar eden yapısal birimlerden oluşur. Bu birimler birbirinin üstüne sarmal biçimde dizilerek bir "deste" oluştururlar, öyle ki aynı ipliğin takip eden tekrarları birbirilerine paralel şekilde hidrojen bağları kurar. Daha çok ayrıntı için beta sarmal maddesine bakınız.
Sol elli β sarmallarda, ipliklerin kendileri düzdür ve burkuk değildir; meydana gelen sarmal yüzeyler neredeyse düzdür, düzenli bir üçgen prizma şekil oluştururlar, sağdaki karbonik anhidraz örneğinde görülebileceği gibi. Diğer örnekler Lipid A sentez enzimi LpxA ve böceklerdeki antifriz proteinleridir. Antifriz proteinlerinin bir yüzündeki düzenli Thr yan zincirlerinin dizilimi, buzun yapısını taklit eder.[12]
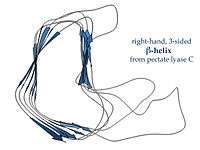
Sağ elli β sarmallar, soldaki pektat liyaz enzimi veya P22 faj kuyruk çıkıntısındaki gibi, düzensiz bir kesite sahiptir, kenarlarından biri daha uzun ve girintilidir; üç bağlayıcı ilmikten biri sadece iki amino asit kalıntısı uzunluğunda, diğer ise değişken uzunlukta olur, çoğu zaman bir ligand bağlanma veya aktif bölge oluşturacak şekilde yapılanmıştır.[13]
İki kenarlı β sarmal (sağ elli) bazı bakteryel metaloproteazlarda bulunur. İki ilmiğinin her biri 6 kalıntı uzunluğundadır ve yapının bütünlüğünü sağlayan, stabilize edici kalsiyum iyonlarına bağlanır. Bu kalsiyum iyonlarına bağlanmak için GGXGXD motifinin omurgası ve Asp yan zincirinin oksijenleri kullanılır.[14] SCOP sınıflandırmasında bu katlanma beta rulosu olarak adlandırılır.
Patolojide β yapraklar
Monomer hâllerinde düzensiz veya sarmal biçimli olan bazı proteinler, amiloid β (amiloid plaka maddesine bakınız), patolojik durumlarla ilişkili β-yaprak zengini oligomerik yapılar oluşturabilirler. Amiloid β proteinin oligomerik şekli Alzheimer hastalığının gelişimi ile ilişkili olduğu bulunmuştur. Bu proteinin yapısı henüz tamamen çözülmüş olmamakla birlikte, iki iplikli bir β sarmal içerdiği yönünde bulgular vardır.[15]
β yaprak yapısında bulunan amino asit kalıntılarının yan zincirleri öyle düzenlenebilir ki, yaprağın bir yüzündeki yan zincirlerin çoğu hidrofobik, öbür yüzündekilerin ise hidrofilik olabilir.[16] Böylece yaprak, polar ile apolar ortamlar arasında yer alabilir.
Ayrıca bakınız
- Katlanma (kimya)
- Üçüncül yapı
- α sarmal
- Kolajen sarmal
- Foldamer
Kaynaklar
- ↑ Voet, Donald; Voet, Judith G. (2004). Biochemistry (3rd bas.). Hoboken, NJ: Wiley. s. 227–231. ISBN 047119350X.
- ↑ Richardson, J.S., and Richardson, D.C. (2002). "Natural β-Sheet Proteins Use Negative Design to Avoid Edge-to-Edge Aggregation". Proc. Nat. Acad. Sci. USA 99 (5): 2754–2759. DOI:10.1073/pnas.052706099. PMC 122420. PMID 11880627. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=122420.
- ↑ FarzadFard, Fahim; et al. (2008). "β-Sheet capping: Signals that initiate and terminate β-sheet formation". Journal of Structural Biology 161 (1): 101–110. DOI:10.1016/j.jsb.2007.09.024. PMID 18006332.
- ↑ Tertiary Protein Structure and Folds: section 4.3.2.1. From Principles of Protein Structure, Comparative Protein Modelling, and Visualisation
- ↑ Hutchinson EG, Thornton JM (April 1993). "The Greek key motif: extraction, classification and analysis". Protein Eng. 6 (3): 233–45. DOI:10.1093/protein/6.3.233. PMID 8506258.
- ↑ SCOP: Fold: WW domain-like
- ↑ PPS '96 - Super Secondary Structure
- ↑ Hutchinson, E.; Thornton, J. (1996). "PROMOTIF—A program to identify and analyze structural motifs in proteins". Protein Science 5 (2): 212–220. DOI:10.1002/pro.5560050204. PMC 2143354. PMID 8745398. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=2143354.
- ↑ Hutchinson EG, Thornton JM (1990). "HERA--a program to draw schematic diagrams of protein secondary structures". Proteins 8 (3): 203–12. DOI:10.1002/prot.340080303. PMID 2281084.
- ↑ Painter PC, Mosher LE, Rhoads C (July 1982). "Low-frequency modes in the Raman spectra of proteins". Biopolymers 21 (7): 1469–72. DOI:10.1002/bip.360210715. PMID 7115900.
- ↑ Chou KC (August 1985). "Low-frequency motions in protein molecules. Beta-sheet and beta-barrel". Biophys. J. 48 (2): 289–97. DOI:10.1016/S0006-3495(85)83782-6. PMC 1329320. PMID 4052563. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=1329320.
- ↑ Liou, Y.C. et al. (2000). "Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein". Nature 406 (6793): 322–324. DOI:10.1038/35018604. PMID 10917536.
- ↑ Branden, Carl; Tooze, John (1999). Introduction to Protein Structure. New York: Garland. s. 20–32. ISBN 0815323050.
- ↑ Bauman, U. et al. (1993). "Three-dimensional structure of the alkaline protease of Pseudomonas aeruginosa: a two-domain protein with a calcium binding parallel beta roll motif". EMBO Journal 12 (9): 3357–3364. PMC 413609. PMID 8253063. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=413609.
- ↑ Nelson R, Sawaya MR, Balbirnie M, Madsen AØ, Riekel C, Grothe R, Eisenberg D (June 2005). "Structure of the cross-beta spine of amyloid-like fibrils". Nature 435 (7043): 773–8. DOI:10.1038/nature03680. PMC 1479801. PMID 15944695. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=1479801.
- ↑ Zhang S., Holme. T, Lockshkin C., Rich A. Proc. Natl. Acad. Sci, 1993 vol. 90: 3334-3338
Daha çok okuma için
- Cooper, J. "Super Secondary Structure - Part II", May 31, 1996. (Süper İkincil Yapı) (İngilizce)
- Structural Classification of Proteins (SCOP) "Open-sided Beta-meander", (Açık kenarlı Beta menderes). (İngilizce)
Dış bağlantılar
- NetSurfP - Secondary Structure and Surface Accessibility predictor (İkincil yapı ve yüzey erişilirlik öngürücüsü)
- Interactive model of an anti-parallel β sheet (anti-paralel β yaprak için enteraktif model) (plug-in required)
- Interactive model of a parallel β sheet (paralel β yaprak için enteraktif model) (plug-in required)
- Animated details of β-pleated sheet (paralel β plili yaprak için animasyonlu detaylar)