Alanin
| Alanin | |
|---|---|
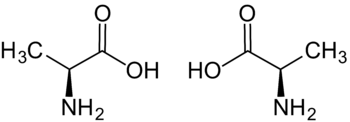 | |
| Alanin L-Alanin (sol) D-Alanin (sağ) | |
| Tanımlayıcılar | |
| CAS numarası | 338-69-2 |
| PubChem | 5950 |
| EC-numarası | 206-126-4 |
| SMILES |
|
| InChI |
|
| ChemSpider | 5735 |
| Özellikler | |
| Molekül formülü | C3H7NO2 |
| Molar kütle | 89,10 g·mol−1 |
| Görünüm | katı, rengsiz ya da sarımsı |
| Yoğunluk | 1,42 g·cm−3 |
| Kaynama noktası |
295–297 °C |
| Çözünürlük (su içinde) | Suda iyi çözülür: |
| Tehlikeler | |
| AB İndeksi | Belirtilmemiş |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
Alanin (Ala, A) (HO2CCH(NH2)CH3) aynı zamanda 2-aminopropanoik asit olarak adlandırılır. En sık kullanılan aminoasittir. Proteinlerin yaklaşık olarak %7.8'i alanin yapıtaşlarından oluşmaktadır. D-alanin, bazı bakterilerin hücre duvarlarında ve peptid antibiyotiklerin yapılarında da bulunmaktadır.
Diğer birçok amino asitte olduğu gibi bu amino asitinde hem L- hemde D- isomeri vardır. Aber aktiv olan diğer bir değişle doğada var olan isomeri L- Alanin’dir. Bu yazıda ya da bilimsel makalelerde Alanin L- ya da D olarak hiçbir ön ek almayarak sadece Alanin diye bahsedilmişse, burda bahsi geçen L- Alanin’dir.
Tarihi
Bu amino asit ilk olarak 1850 yılında Adolph Strecker tarafından sentezlenmiş ve adlandırılmıştır.[1] L-Alanin ilk defa T. Weyl tarafından 1888 yılında proteinlerin bir parçası oluğu ipeğin elyaflarının incelenmenmesiyle ortaya koymuştur.[2] Protein zincirinde kullanılan amino asitlerin % 29,7’ si L-Alanin’den oluşmaktadır.[3]
Yapısı
Alanin, moleküler yapısı en basit olan alifatik amino asitlerden biridir. Alaninin yapısında bulunan alfa-karbon atomu yan zincir olarak bir metil(-CH3) grubuna bağlanmıştır.
Sentezi
Alanin, tememetabolizmasında (glikoliz, glukoneogenez, Krebs döngüsü) önemli bir yere sahiptir
Fonksiyonları
Alanindeki metil grubu kimyasal olarak oldukça inaktif olması nedeniyle protein fonksiyonunda ancak dolaylı olarak katkıda bulunabilir. Buna rağmen, özellikle karbon gibi apolar atomlarla hidrofobik bağlar yapabilmesi sebebiyle, alanin substrat tanınmasında ve enzim-substrat ilişkisinin özgül olmasında rol oynayabilmektedir.
Kaynakları
Hemen hemen tüm proteinler alanin içermektedirler. Dolayısıyla protein içeren et, süt, yumurta gibi genel besinler aynı zamanda zengin birer alanin kaynağıdır.
Kaynakça
- ↑ Adolph Strecker: Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper. In: Annalen der Chemie und Pharmacie. 75, 1850, S. 27–45.
- ↑ T. Weyl: In: Berichte der deutschen Chemischen Gesellschaft. 21 (1888), S. 1407.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2, S. 19.
| ||||||