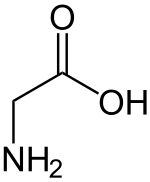
Glisin
| Glisin | |
|---|---|
 | |
| Glisin | |
| Tanımlayıcılar | |
| CAS numarası | 56-40-6 |
| PubChem | 750 |
| EC-numarası | 200-272-2 |
| SMILES |
|
| InChI |
|
| ChemSpider | 730 |
| Özellikler | |
| Molekül formülü | C2H5NO2 |
| Molar kütle | 75.07g·mol−1 |
| Görünüm | Katı,rengsiz kiristal görünümlü |
| Yoğunluk | 1.607 g·cm−3 |
| Erime noktası |
232–236 °C' parçalanır |
| Çözünürlük (su içinde) | Suda iyi çözülür: 249,9 g·kg−1 25 °C'ta; 391,0 g·kg−1 50 °C'ta; 543,9 g·kg−1i 75 °C'ta; 671,7 g·kg−1 100 °C'ta) |
| Tehlikeler | |
| AB İndeksi | Belirtilmemiş |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
Glisin (kısaltılmışı Gly ya da G) formülü NH2CH2COOH olan apolar bir aminoasittir. Glisin kodonları GGU, GGC, GGA, GGG cf. genetik kodtur.Yapısal olarak proteinlerde bulunan 20 aminoasit arasında en basit olanıdır. Yan zinciri sadece bir hidrojen atomundan ibarettir. Glisindeki α-karbon atomu da bir hidrojene bağlı olduğu için, glisin optik olarak aktif değildir, diğer bir deyişle optik izomeri bulunmamaktadır.
Özellikleri
Yan zincirinin olmamasından dolayı iki polipeptid ana zincirinin (veya aynı polipeptid segmentinin) birbirlerina oldukça yakınlaşabilecekleri bölümleri oluştururlar. Ayrıca glisin, diğer amino asitlerden çok daha fazla esnektir, bu sayede ana zincirin hareket ettiği ve hatta kırıldığı bölümlerdir.
Glisin en küçük aminoasit olması nedeniyle diğer aminoasitlerin sığamadığı birçok yere sığabilmektedir. Örnek olarak, kollajen heliksinin içinde aminoasitlerden sadece glisin bulunabilmektedir.
Glisin, evrimsel olarak bazı proteinlerin belli pozisyonlarında sürekli olarak korunmuştur (örnek olarak, sitokrom c, myoglobin ve hemoglobin). Çünkü glisini daha büyük bir aminoasitle değiştiren mutasyonlar bu proteinlerin yapısını tamamen bozmaktadırlar.
Glisin renksiz, tatlımsı kristal bir katıdır. Proteinler genellikle az sayıda glisin yapıtaşı içermektedir. Üçte biri glisinden oluşan kollajen ise bir istisnadır.
Tarihi
Glisin 1820 yılında, Henri Braconnot tarafından jelatinin sülfürik asit içerisinde kaynatılmasıyla keşfedildi.[2]
Ticari Üretimi ve Kullanımı
Glisin endüstriyel olarak kloroasetik asitin amonyakla reaksiyonundan üretilmektedir:[3]
- ClCH2COOH + 2 NH3 → H2NCH2COOH + NH4Cl
Yılda yaklaşık 15 milyon kg glisin bu şekilde üretilmektedir.[4]
Amerika (GEO Specialty Chemicals, Inc.) ve Japonya (Showa Denko firması)’da, glisin Strecker amino asit sentezi yoluyla üretilmektedir.[5]
Glisinin pKA değeri 2.35 ile 9.78 arasında olur. pH 9.78 üstünde ise glisinin büyük bölümü anyonik amin ( H2NCH2CO2-) şeklindedir. pH 2.35 altında, glisin çözeltisi çoğunlukla katyonik karboksilik asit (H3N+CH2CO2H) içerir. Glisinin izoelektrik noktası 6.06 dır.
Glisin çözelti halinde zwitter iyon halinde bulunur. Bu halde iken, Gasteiger yük yöntemi kullanılarak belirlenmiş farklı atomlardaki kısmi yükler şu şekilde verilmiştir: N (+0.2358), H (N atomuna bağlı) (+0.1964), alfa-C (+0.001853), H (alfa-C atomuna bağlı) (+0.08799), karbonil C (+0.085) ve karbonil O (-0.5445).
Kimyasal hammadde
Glisin, çeşitli kimyasal ürünlerin sentezinde kullanılan bir ara üründür. Glifosat etkili maddeli herbisit üretiminde kullanılır. Glifosat, yabancı otları öldürmeye yarayan seçici olmayan sistemik bir herbisittir. Özellikle tohumlu ve çok yıllık ya da kesilmiş ağaçların toprak altında kalan bölümünü kurutmak için bir orman herbisiti olarak kullanılır. Glifosat, ilk olarak Roundup ticari markası altında Monsanto tarafından satıldı ise de artık patent altında olmadığı için birçok firma tarafından piyasaya sunulmaktadır.
Fizyolojik fonksiyonları
Glisin, merkezi sinir sisteminde, özellikle omurilik, beyin kökü ve retinada olmak uzere inhibitör (sinir iletişimini engelleyici) bir nörotransmiterdir. Nöronlar üzerindeki glisin reseptörleri glisin tarafından uyarıldığında, nöronun içine iyonotropik reseptörler vasıtasıyla Cl- akışı gerçeklesir. Negatif yüklü iyonların nöron içerisinde birikmesi inhibitör postsinaptik potansiyele neden olur. Nöronun uyarılması daha da zorlaşır. Strychnine iyonotropik glisin reseptörleri üzerinde etkili bir antagonisttir. Glisin insan vücudundaki hücreler tarafından fizyolojik ihtiyaçları karşılayacak miktarda sentezlenebildiği için beslenme yoluyla dışarıdan alımı şart değildir.
Yer aldığı metabolik olaylar
- Safra tuzu sentezi
- Pürin sentezi
- Hippurat sentezi(Sodyum benzoat ile oluşturduğu yapı)
- Sarkozin(N-metil glisin) sentezi
- Kreatin sentezi
- Porfirin sentezi
- Glutatyon sentezi
Metabolik bozuklukları
Glisinüri Plazma glisin düzeyi normal,glisinin yanı sıra prolin ve hidroksiprolinin renal tübüler geri emilimi bozuktur.
Primer hiperoksalüri Glisinin glioksalata oksidasyonunda artış bulunur ve glioksalat katabolizması bozulduğundan oksalata oksidasyon artar.Oksalat taşı,tekrarlayıcı idrar yolu enfeksiyonları,renal yetersizlik,hipertansiyon gözlenir.
Hiperglisinemi Glisin yıkımında yer alan glisin yarılma enzim yapılarındaki hataya bağlı olarak görülen kalıtsal bir hastalıktır.Zeka geriliği ve nöbetler ile tanınır.Propiyonik asidemili hastalarda gözlenir.Non-ketotik hiperglisinemi de denir.Tedavide sodyum benzoat kullanılır.
Kaynakça
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 19, 1982, ISBN 3-527-25892-2.
- ↑ R.H.A. Plimmer (1912) [1908]. R.H.A. Plimmer & F.G. Hopkins. ed. The chemical composition of the proteins. Monographs on biochemistry. Part I. Analysis (2nd bas.). London: Longmans, Green and Co.. s. 82. http://books.google.com/?id=7JM8AAAAIAAJ&pg=PA112. Erişim tarihi: January 18, 2010.
- ↑ Şablon:OrgSynth.
- ↑ Karlheinz Drauz, Ian Grayson, Axel Kleemann, Hans-Peter Krimmer, Wolfgang Leuchtenberger, Christoph Weckbecker “Amino Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a02_057.pub2
- ↑ http://www.usitc.gov/trade_remedy/731_ad_701_cvd/investigations/2007/glycine_from_india_japan_korea/preliminary/DOC/Glycine%20Conference%20(prelim).wpd
| ||||||