Soy gaz
Soy gazlar, çok benzer kimyasal yapılara sahip bir kimyasal element grubudur. Standart şartlar altında tamamı çok düşük kimyasal reaktifliğe sahip, kokusuz, renksiz tek atomlu gazlardır. Helyum (He), Neon (Ne), Argon (Ar), Kripton (Kr), Ksenon (Xe), ve radyoaktif Radon (Rn) doğal olarak bulunan altı soy gazdır.
Periyodik tablonun ilk altı periyodu için, soy gazlar tümüyle periyodik tablonun 18. grubunda (8A) (daha önceden bilinen adıyla 0. grup) yer alır. Ancak bu rölativistik etkilerden dolayı yedinci periyot için geçerli değildir. 18. grubun bir sonraki üyesi ununoktiyum muhtemelen bir soy gaz değildir.[1] Bunun yerine 14. grup üyesi olan ununkuadyum soy gaz benzeri özellikler gösterir.[2]
Soy gazların niteliği en iyi atomik yapının modern teorileri ile açıklanır. Soy gazların en dış elektron kabuğu tamamen elektronlarla doludur, dolayısıyla kimyasal tepkime eğilimleri düşüktür. Bu sebeple sadece birkaç yüz tane soy gaz bileşiği elde edilebilmiştir. Her bir soy gazın erime ve kaynama noktaları birbirine çok yakındır (fark sadece 10 °C veya 18 °F mertebesindedir), bu nedenle bu gazlar küçük sıcaklık aralıklarında sıvı halde bulunurlar.
Neon, argon, kripton ve ksenon gazların sıvılaştırılması ve ayrımsal damıtma yöntemleri kullanılarak havadan elde edilir. Helyum genellikle doğal gazdan ayrıştırılır ve radon da genellikle çözünmüş radyum bileşiklerinin radyoaktif bozunumundan izole edilerek elde edilir. Soy gazlar aydınlatma, kaynak ve uzay keşfi gibi endüstri alanlarında önemli bir kullanıma sahiptir. Bir helyum oksijen solunum gazı, derin su dalıcıları tarafından, 180 fit (55 m)'nin üzerindeki derinliklerde, dalıcıları oksijen zehirlenmesi, yüksek basınçlı oksijenin ölümcül etkisi ve derinlik sarhoşluğu gibi tecrübelerden sakınmak amacıyla kullanılır. Hidrojenin yanıcılığından dolayı meydana gelen riskler belirgin olduğunda balonlarda ve zeplinlerde bu gazın yerini helyum aldı.
Tarih
Almanca Edelgas sözcüğünün çevirisi olan soy gaz terimi ilk kez 1898'de Hugo Erdmann[3] tarafından bu elementlerin son derece düşük kimyasal tepkimeye girme eğilimlerini belirtmek için kullanıldı. Bu isim, düşük kimyasal tepkime eğilimine sahip olmasının yanı sıra refah ve soylulukla ilişkilendirilen altın gibi metallerin dahil olduğu "soy metaller" adıyla benzerlik gösterir. Soy gazlar ayrıca inert gazlar (atıl, durgun ya da ölü gaz) olarak da anılır, ancak birçok soy gaz bileşiğinin tanınmasından sonra bu yakıştırma uygun bulunmamaktadır.[4] Nadir gazlar bu elementler için kullanılmış olan bir başka terimdir,[5] ancak bu da doğru olmayan bir isimdir, çünkü argon gazı Dünya atmosferinin dikkate değer bir kısmını (hacimde %0.94 ve kütlede %1.3) oluşturur.[6]
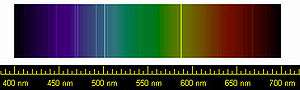
Pierre Janssen ve Joseph Norman Lockyer 18 Ağustos 1868'de Güneş'in renkyuvarına bakarken ilk kez bir soy gaz keşfettiler ve Yunanca Güneş anlamına gelen ήλιος (ílios veya helios) sözcüğünü alarak elemente helyum adını verdiler.[7] Onlardan önce 1784'te İngiliz kimyager ve fizikçi Henry Cavendish, havanın azottan daha az reaktif küçük oranlarda bir madde içerdiğini keşfetti.[8] Bir asır sonra, 1895'te, Lord Rayleigh, havadaki azot örneklerinin yoğunluğunun, kimyasal reaksiyonlar sonucunda oluşan azotun yoğunluğundan farklı olduğunu keşfetti. University College, London'da William Ramsay ile birlikte Lord Rayleigh havadan çıkarılan azotun başka bir gaz ile karışık olduğunu kuramsallaştırdı. Ardından yapılan deney sonucunda yeni bir element başarılı bir şekilde izole edildi ve elemente Yunanca αργός (argós, "inaktif") sözcüğünden argon ismi verildi.[8] Bu keşifle birlikte periyodik tabloda bütün bir sınıf gazın noksan olduğunu farkettiler. Argon üzerindeki çalışmalarını sürdürürken Ramsay, bir taraftan da kleveyit mineralini ısıtırken helyumu ilk kez izole etmeyi başardı. 1902'de helyum ve argon elementleri için kanıtların kabul edilmesiyle Dmitri Mendeleev, bu gazları daha sonra periyodik tablo olacak olan element dizilimine 0. grupta yer alacak şekilde yerleştirdi.[9]
Ramsay bu gazlar üzerindeki çalışmalarına, sıvı havayı birçok bileşene ayırdığı ayrımsal damıtma yöntemini kullanarak devam etti. 1898'de kripton, neon ve ksenon elementlerini keşfetti ve onlara sırasıyla Yunancadaki κρυπτός (kryptós, "saklı"), νέος (néos, "yeni") ve ξένος (xénos, "yabancı") isimlerini verdi. Radon ilk kez Friedrich Ernst Dorn tarafından 1898'de tanımlandı,[10] ve radyum emanasyonu şeklinde isimlendirildi, ancak özelliklerinin diğer soy gazlara benzediğinin bulunduğu 1904 yılına kadar soy gaz olarak kabul edilmedi.[11] Rayleigh ve Ramsay 1904'te soy gaz keşiflerinden dolayı sırasıyla fizik ve kimya dallarında Nobel Ödülü kazandılar.[12][13]
Soy gazların keşfi atomun yapısının anlaşılması yönündeki gelişmelere yardım etti. 1895'te Fransız kimyager Henri Moissan en elektronegatif element olan flor ve bir soy gaz olan argon arasında kimyasal tepkime yaratmaya çalıştı, ancak başarısız oldu. Bilim insanları 20. yüzyılın sonlarına kadar argon bileşiği hazırlamakta başarısız oldu, ancak bu denemeler atomun yapısı ile ilgili yeni kuramların geliştirilmesine yardım etti. 1913'te Danimarkalı fizikçi Niels Bohr bu deneylerden öğrendikleriyle bir atomdaki elektronların, atomun çekirdeğini çevreleyen kabuklarda (yörüngelerde) dizildiğini ve helyumun dışındaki bütün soy gazların en dış elektron kabuğunun her zaman için sekiz elektron barındırdığını öne sürdü.[11] 1916'da Gilbert N. Lewis oktet kuralını formüle etti. Buna göre atomlar en dış kabuklarındaki elektron sayısını sekize tamamlama eğilimindedir. Bu düzenlemeyle en dış kabukları tamamen dolu olan atomlar, daha fazla elektrona ihtiyaç duymayacakları için diğer elementlere karşı tepkisizleşirler.[14]
Neil Bartlett'in 1962'de ilk kimyasal soy gaz bileşiği ksenon heksafloroplatinatı keşfetti.[15] Çok geçmeden diğer soy gazların da bileşikleri keşfedildi: 1962'de radon için radon diflorür[16] ve 1963'te kripton için kripton diflorür (KrF2) keşfedildi.[17] 40 K (−233.2 °C; −387.7 °F) sıcaklık altında oluşturulan argonun ilk kararlı bileşiği argon florohidrür (HArF) 2000 yılında rapor edildi.[18]
Aralık 1998'de Dubna, Rusya'daki Ortak Nükleer Araştırma Enstitüsü (Joint Institute for Nuclear Research-JINR) çalışanı bilim insanları, geçici olarak Ununkuadyum (Uuq) ismi verilen[19] 114. elementi üretebilmek için plütonyumu (Pu), kalsiyum (Ca) ile bombardıman etti.[20] Başlangıç deneyleri bu elementin periyodik tablonun 14. grubunda yer almasına rağmen anormal soy gaz benzeri yapıya sahip olan ilk süper ağır element olabileceğini gösterdi.[21] Ekim 2006'da Ortak Nükleer Araştırma Enstitüsü ve Lawrence Livermore Ulusal Laboratuvarı'ndaki bilim insanları kaliforniyumu (Cf) kalsiyum (Ca) ile bombardıman ederek[22] 18. gruptaki yedinci element ununoktiyumu (Uuo) sentetik olarak elde etti.[23]
Fiziksel ve atomik özellikleri
| Özellik[11][24] | Helyum | Neon | Argon | Kripton | Ksenon | Radon |
|---|---|---|---|---|---|---|
| Yoğunluk (g/dm³) | 0.1786 | 0.9002 | 1.7818 | 3.708 | 5.851 | 9.97 |
| Kaynama noktası (K) | 4.4 | 27.3 | 87.4 | 121.5 | 166.6 | 211.5 |
| Erime noktası (K) | 0.95[25] | 24.7 | 83.6 | 115.8 | 161.7 | 202.2 |
| Buharlaşma entalpisi (kJ/mol) | 0.08 | 1.74 | 6.52 | 9.05 | 12.65 | 18.1 |
| 20 °C (cm3/kg) sudaki çözünürlüğü | 8.61 | 10.5 | 33.6 | 59.4 | 108.1 | 230 |
| Atom numarası | 2 | 10 | 18 | 36 | 54 | 86 |
| Atom yarıçapı (hesaplanan) (pm) | 31 | 38 | 71 | 88 | 108 | 120 |
| İyonlaşma enerjisi (kJ/mol) | 2372 | 2080 | 1520 | 1351 | 1170 | 1037 |
| Allen elektronegatifliği[26] | 4.16 | 4.79 | 3.24 | 2.97 | 2.58 | 2.60 |
Soy gazlar zayıf atomlar arası kuvvete sahiptir, bu nedenle erime ve kaynama noktaları oldukça düşüktür. Normalde katı olan elementlerin çoğundan daha büyük atom kütlesine sahip olanlar da dahil olmak üzere soy gazların tamamı standart koşullar altında tek atomlu gazlardır.[11] Helyum diğer elementlerle karşılaştırıldığında birçok eşsiz niteliğe sahiptir; elementin erime noktası bilinen diğer bütün maddelerden daha düşüktür; süperakışkanlık gösteren tek elementtir; standart şartlar altında soğutularak katılaştırılamayan tek elementtir (helyumu katılaştırmak için 25 atm (2,500 kPa; 370 psi), 0.95 K (−272.200 °C; −457.960 °F) sıcaklıkta uygulanmalıdır).[27] Ksenona kadarki soy gazlar birden çok kararlı izotopa sahiptir. Radonun kararlı izotopu bulunmamaktadır; bu soy gazın en uzun ömürlü izotopu olan 222Rn'nin yarı ömrü 3.8 gündür ve helyum ve polonyuma, nihayetinde de kurşuna bozunur. [11]
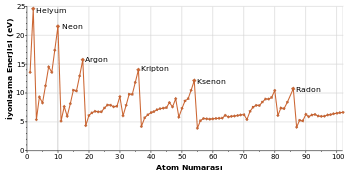
Soy gaz atomlarının, diğer çoğu gruplardaki atomlarda olduğu gibi, elektron sayısındaki artışa bağlı olarak bir periyottan diğerine geçişte atom yarıçapı yükselir. Atomun büyüklüğü birkaç niteliğe bağlıdır. Örneğin iyonizasyon potansiyeli yarıçapla birlikte artar çünkü büyük soy gazların valans elektronları çekirdekten çok uzaktadırlar ve bu yüzden atom tarafından sıkıca tutulamazlar. Soy gazlar her bir periyottaki elementler içerisinde en büyük iyonizasyon potansiyeline sahiptirler. Bu durum onların elektron konfigürasyonlarının kararlılığını yansıtır ve soy gazların göreli düşük kimyasal tepkimeye girme eğilimleriyle bağlantılıdır.[24] Yine de bazı ağır soy gazlar, diğer elementler ve moleküllerle karşılaştırılmalarına yetecek kadar küçük iyonizasyon potansiyeline sahiptir. Ksenonun iyonizasyon potansiyelinin oksijen molekülününki ile benzer olduğunu farkeden Bartlett, oksijenle çok güçlü bir şekilde tepkimeye girdiği bilinen bir oksitleyici ajan, platinyum heksaflorür kullanarak ksenonu oksitleme denemesinde bulundu.[15] Soy gazlar kararlı anyonlar oluşturacak bir elektronu kabul edemezler; yani onlar negatif elektron ilgisine sahiptir.[28]
Soy gazların makroskobik fiziksel özelliklerinde atomlar arasındaki zayıf van der Waals kuvvetleri hakimdir. Kutuplanabilirlikteki artış ve iyonizasyon potansiyelindeki düşüşün sonucu olarak atomun boyutu ve çekici kuvvet artar. Bu sistematik grup eğilimiyle sonuçlanır: 18. gruptan aşağı gidilirken atom yarıçapıyla atomlararası kuvvetler artar ve sonuçta erime ve kaynama noktaları, buharlaşma entalpisi ve çözünürlük yükselir. Atom kütlesinin artamasıyla da yoğunluk artar.[24]
Soy gazlar standart koşullar altında, neredeyse ideal gazlardır, ancak bu gazların ideal gaz yasasından sapması moleküller arası etkileşimlerin araştırılmasında önemli ipuçları sağlar.
Kimyasal özellikleri
Soy gazlar standart şartlar altında renksiz, kokusuz, tatsız ve yanmazdır. Bu elementler eskiden periyodik tablonun 0. grubu olarak anlıyordu, çünkü soy gazların sıfır valansa sahip olduğuna ve atomlarının diğer elementler ile birleşip bileşik oluşturamayacağına inanılıyordu. Ancak sonra bazılarının bileşik oluşturabildiği bulunduğunda bu isimlendirme kullanımdan kalktı.[11] 18. grubun en yeni üyesi ununoktiyumun (Uuo) özellikleri hakkında bilinenler çok kısıtlıdır.[29]
Diğer gruplar gibi bu ailenin üyeleri de elektron konfigürasyonlarında örnekler gösterir, özellikle en dış elektron kabuğu kimyasal davranıştaki eğilimin sonucudur:
| Z | Element | Elektron sayısı/kabuk |
|---|---|---|
| 2 | helyum | 2 |
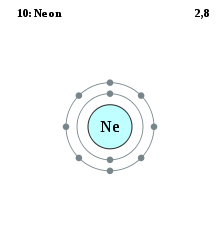
| 10 | neon | 2, 8 |
| 18 | argon | 2, 8, 8 |
| 36 | kripton | 2, 8, 18, 8 |
| 54 | ksenon | 2, 8, 18, 18, 8 |
| 86 | radon | 2, 8, 18, 32, 18, 8 |
| 118 | ununoktiyum | 2, 8, 18, 32, 32, 18, 8 |
Soy gazlar tamamen dolu valans elektron kabuğuna sahiptir. Valans elektronları bir atomun en dış elektronlarıdır ve normal olarak kimyasal bağa iştirak eden yegane elektronlardır. Tamamen dolu valans elektron kabuğuna sahip atomlar son derece kararlıdır bu yüzden kimyasal bağ oluşturma eğilimi göstermezler ve elektron kaybetmeye ya da kazanmaya az meyillidirler.[30] Ancak radon gibi ağır soy gazlarda, helyum gibi daha hafif soy gazlardakine oranla, elektromanyetik kuvvet elektronları sıkıca bir arada tutamaz, bu sayede ağır soy gazların en dış elektronlarının çıkarılması daha kolaydır.
Dolu kabuğun sonucu olarak, soy gazlar elektron konfigürasyonu notasyonu ile birlikte soy gaz notasyonunu oluşturabilirler. Bunu yapmak için söz konusu elementten önce gelen soy gaz önce yazılır ve sonrasında elektron konfigürasyonu bu noktadan ileriye doğru devam ettirilir. Örneğin karbonun elektron notasyonu 1s²2s²2p² şeklindedir ve soy gaz notasyonu da [He]2s²2p²'dir. Bu notasyon elementlerin tanımlanmasını kolaylaştırır ve bütün atomik yörüngelerin yazılmasından daha kısadır.[31]
Bileşikleri
Soy gazlar son derece düşük kimyasal reaktiflik gösterir; bundan dolayı sadece birkaç yüz tane soy gaz bileşiği oluşmuştur. Ksenon, kripton ve argon sadece küçük düzeylerde reaktiflik gösterirken, helyum ve neonun dahil olduğu kimyasal bağlarda yüksüz bileşik oluşmaz (yine de birkaç helyum bileşiğinin varlığına dair kuramsal kanıtlar mevcuttur).[32] Soy gazların reaktiflik sıralaması Ne < He < Ar < Kr < Xe < Rn şeklindedir.
1933'te Linus Pauling, ağır soy gazların flor ve oksijen ile bileşik oluşturabileceğini tahmin etti. Pauling kripton heksaflorür (KrF6) ve ksenon heksaflorür (XeF6) bileşiklerinin varolduğunu ve XeF8'nin kararsız bir bileşik olabileceğini öngördü ve ksenik asitin perxenate tuzları olşturabileceğini ortaya attı.[33][34] Şimdilerde hem termodinamik olarak hem de kinetik olarak kararsız olduğu düşünülen XeF8 dışındaki bu öngörülerin genel olarak doğru olduğu gösterildi.[35]
Ksenon bileşikleri soy gaz bileşiklerinin en kalabalık grubudur.[36] Bu (ksenon diflorür (XeF2), ksenon tetraflorür (XeF4), ksenon heksaflorür (XeF6), ksenon tetroksit (XeO4), ve sodyum perxenate (Na4XeO6) gibi) bileşiklerin çoğunda oksidasyon seviyesi +2, +4, +6 veya +8 olan ve oksijen ve flor gibi son derece elektronegatif atomlarla bağ oluşturan ksenon atomu bulunur. Bu bileşiklerin bazıları kimyasal sentezde oksitleyici ajan olarak kullanılır: özellikle florinasyon ajanı olarak kullanılan XeF2 piyasada mevcuttur.[37] 2007'ye kadar, organoksenon bileşikleri (bunlar karbona bağlıdır) ve azot, klor, altın, cıva, ksenonun kendisine bağlı olanları da içeren diğer elementlere nağlı halde yaklaşık beş yüz ksenon bileşiği belirlendi.[32][38] Ksenonun bor, hidrojen, brom, iyot, berilyum, sülfür, titanyum, bakır ve gümüşe bağlandığı bileşikler de görülmüştür ancak sadece düşük sıcaklıklarda soy gaz matrislerinde veya süpersonik soy gaz jetlerinde.[32]
Teoride radon ksenondan daha reaktif olduğundan ksenonun yaptığından daha kolay kimyasal bağ oluşturması beklenir. Ancak radon izotoplarının yüksek radyoaktivitesi ve kısa ömrü sebebiyle radon pratikte sadece birkaç florür ve oksit oluşturabilir.[39]
Kripton ksenondan daha az reaktiftir, ancak +2 oksidasyon durumunda birkaç kriptonlu bileşik bildirilmiştir.[32] Kripton diflorür en bilinen ve kolayca karakterize edilebilen bileşiktir. Kriptonun azot ve oksijen ile tek bağ oluşturduğu da bilinmektedir[40] ancak bunlar sadece −60 °C (−76.0 °F) ve −90 °C (−130.0 °F) sıcaklıklarının altında kararlıdır.[32]
Kripton atomlarının diğer ametallerle (hidrojen, klor, karbon) ve bazı geçiş metalleriyle (bakır, gümüş, altın), kimyasal bağları gözlendi ancak sadece ya düşük sıcaklıklarda soy gaz matrikslerinde ya da süpersonik soy gaz jetlerinde gözlendi.[32] Benzer koşullar 2000'de argon florohidrür (HArF) gibi argonun ilk birkaç bileşiğinin ve bazı geçiş metalleriyle oluşturduğu bağların elde edilmesinde kullanıldı.[32] 2007 itibarı ile bilinen helyum ve neonun dahil olduğu kovalent bağlı herhangi bir kararlı nötral molekül bulunmamaktadır.[32]
Helyum da dahil olmak üzere soy gazlar kararlı moleküler iyonlar oluşturabilir. Bunun en basiti 1925'te keşfedilen helyum hidrit moleküler iyonudur (HeH+).[41] Evrendeki en bol iki elementin (hidrojen ve helyum) bileşiminden oluştuğu için bu iyonun, henüz saptanmamış olsa da, yıldızlararası ortamda doğal olarak bulunabileceğine inanılıyor.[42] Bu iyonlara ek olarak soy gazların bilinen birçok nötr eksimeri bulunmaktadır. Bunlar sadece uyarılmış elektron durumunda kararlı olan ArF ve KrF gibi bileşiklerdir. Bu bileşiklerden bazıları eksimer lazerlerde kullanılır.
Soy gazlar kovalent bağ oluşturdukları bileşiklere ek olarak non-kovalent bağla da bileşik oluşturabilirler. İlk kez 1949'da tanımlanan[43] kafes bileşikleri, belli başlı organik ve inorganik maddelerin kristal kafeslerindeki boşluklarda (kavite) tuzaklanmış soy gazlar içerir. Bunların oluşumu için gerekli şart, ziyaretçinin (soy gaz) ev sahibi kristal kafesin boşluğuna yerleşebilmesi için uygun boyutta olmasıdır. Örneğin argon, kripton ve ksenon, hidrokuinon ile klatrat oluşturabilir ancak helyum ve neon çok küçük olduğundan veya tutulabilmesi için yeterince kutuplanabilir olmadığından, oluşturamaz.[44] Neon, argon, kripton ve ksenon soy gazın buz içinde tuzaklandığı klatrat hidratlar da oluşturabilir.[45]
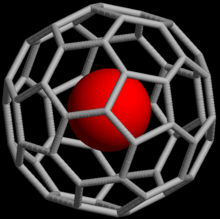
Soy gazlar, soy gaz atomunun fulleren molekülü içinde tuzaklandığı endohedral fulleren bileşikleri oluşturabilir. 1993'te 60 karbon atomu içeren bir küresel molekül C60 yüksek basınç altında soy gazlara maruz bırakıldığında He@C60 gibi koordinasyon bileşiklerinin (kompleks) oluşabileceği keşfedildi (@ notasyonu He'nin C60 içerdiğini ancak ona kovalent olarak bağlanmadığını belirtir).[46] 2008 itibarı ile helyum, neon, argon, kripton ve ksenonlu endohedral kompleksler elde edildi.[47] Bu bileşikler, soy gaz atomunun nükleer manyetik rezonansı vasıtasıyla fullerenlerin yapısı ve reaktivitesinin incelenmesinde kullanım bulmuştur.[48]
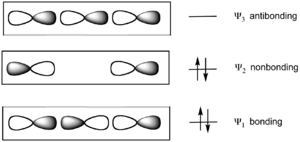
Ksenon diflorür (XeF2) gibi soy gaz bileşikleri, oktet kuralını ihlal ettikleri için hipervalent olarak kabul edilirler. Bu bileşiklerdeki bağlanma bir 3-merkez-4-elektron bağ modeli kullanılarak açıklanabilir.[49][50] İlk olarak 1951'de önerilen bu model üç doğrudaş (kolineer) atomun bağlanmasını göz önünde bulundurur. Örneğin XeF2'deki bağlanma her atomun p-orbitalinden kaynaklanan üç moleküler orbital (MOs) ile tanımlanır. Bağlanma Xe'den gelen dolu bir p-orbitali ve her bir F atomundan gelen yarı dolu bir p-orbitalinden ileri gelir, bu da dolu bir bağ orbitali, dolu bir bağ yapmayan orbital ve bir bağönler orbital ile sonuçlanır. En yüksek dolu moleküler orbital (HOMO) iki uç atomda lokalize olmuştur. [51]
Bulunuş ve üretim
Soy gazların atom numaraları arttıkça, evrendeki bollukları azalır. Yaklaşık %24'lük kütle kesri ile helyum, hidrojenden sonra evrendeki en yaygın elementtir. Evrendeki helyumun büyük kısmı Büyük Patlama nükleosentezi sırasında oluşmuştur ancak yıldız nükleosentezindeki hidrojen füzyonu sebebiyle helyum miktarı durmadan artmaktadır.[52][53] Dünya'daki bolluk farklı eğilimlere bağlıdır. Örneğin helyum, atmosferdeki yalnızca üçüncü en bol soy gazdır. Bunun sebebi, atmosferde hiç ilkel helyumun bulunmamasıdır: atomunun küçük kütleli olması nedeniyle helyum, Dünya'nın yerçekim alanında tutulamamıştır.[54] Dünya'daki helyum, yerkabuğunda bulunan uranyum ve toryum gibi ağır elementlerin alfa bozunumundan gelir ve doğal gaz birikintilerinde toplanma eğilimindedir. Diğer taraftan argonun bolluğu, yine Dünya'nın kabuğunda bulunan potasyum-40'ın, Güneş Sistemi'nde göreli olarak seyrek bulunmasına rağmen Dünya'daki en bol argon izotopu olan argon-40'ı beta bozunum ile oluşturmasına bağlı olarak artar. Bu süreç, potasyum-argon tarihlendirmesi yönteminin temelidir.[55] Beklenmedik bir şekilde ksenonun atmosferdeki bolluğu düşüktür. Kayıp ksenon problemi olarak anılan bu olay bir teoriye göre ksenonun yerkabuğunda bulunan minerallerce tuzaklanmasından kaynaklanmaktadır.[56] Radon litosferde radyumun alfa buzunumu yapması sonucunda oluşur. Binaların temelindeki yarıklardan içeri sızabilen radon iyi havalandırılmayan alanlarda birikebilir. Yüksek radyoaktifliği dolayısı ile önemli bir sağlık tehdidi olan radon sadece ABD'de yılda yaklaşık 21,000 akciğer kanseri kaynaklı ölüme sebep olmaktadır.[57]
| Bolluk | Helyum | Neon | Argon | Kripton | Ksenon | Radon |
|---|---|---|---|---|---|---|
| Güneş Sistemi (her bir silisyum atomu için)[58] | 2343 | 2.148 | 0.1025 | 5.515 × 10−5 | 5.391 × 10−6 | – |
| Dünya atmosferi (hacim kesri ppm)[59] | 5.20 | 18.20 | 9340.00 | 1.10 | 0.09 | (0.06 – 18) × 10−19[60] |
| Volkanik kaya (kütle kesri ppm)[24] | 3 × 10−3 | 7 × 10−5 | 4 × 10−2 | – | – | 1.7 × 10−10 |
| Gas | 2004 fiyatı (USD/m3)[61] |
|---|---|
| Helyum (endüstriyel sınıf) | 4.20–4.90 |
| Helyum (laboratuvar sınıfı) | 22.30–44.90 |
| Argon | 2.70–8.50 |
| Neon | 60–120 |
| Kripton | 400–500 |
| Ksenon | 4000–5000 |
Neon, argon, kripton ve ksenon gazların sıvılaştırılması yöntemi kullanılarak havadan elde edilir. Böylece elementler sıvı hale getirilir ve ayrımsal damıtma yöntemi ile de karışım bileşenlere ayrılır. Helyum genellikle doğal gazdan ayrılarak üretilir ve radon radyum bileşiklerinin radyoaktif bozunumundan izole edilir.[11] Soy gazların fiyatı doğal bulunuşlarından etkileşnmiştir. Argon en ucuzu iken ksenon en pahalı soy gazdır. Bir örnek oluşturması için sağdaki listede her bir gazın laboratuvar miktarı için ABD'deki 2004 fiyatları verilmiştir.
Kullanım
Soy gazlar çok düşük erime ve kaynama noktasına sahiptir, bu yüzden de kriyojenik soğutucu olarak kullanışlıdırlar.[62] Özellikle kaynama noktası 4.2 K (−268.95 °C; −452.11 °F) olan sıvı helyum, nükleer manyetik rezonans görüntüleme ve nükleer manyetik rezonansta ihtiyaç duyulan, süper iletkenli mıknatıslar için kullanılır.[63] Sıvı neon, sıvı helyum kadar düşük sıcaklıklara ulaşamamasına rağmen kriyojenikte kullanılır çünkü sıvı helyumdan 40 kat ve sıvı hidrojenden üç kattan fazla soğutma kapasitesine sahiptir.[60]
Helyum, sıvılardaki özellikle de lipitlerdeki düşük çözünürlüğü sebebiyle solunum gazı bileşeni olarak azotun yerine kullanılır. Gazlar, aletli dalışta olduğu gibi basınç altında kan ve doku tarafından absorbe edilir ve derinlik sarhoşluğu (azot narkozu) olarak bilinen anestezik etkiye sebep olur.[64] Düşük çözünürlüğü nedeniyle az miktarda helyum hücre zarlarından içeri alınır ve helyum trimix (helyum-oksijen-nitrojen) ve heliox'ta (helyum-oksijen) olduğu gibi solunum gazı parçası olarak kullanılırsa gazın derindeki narkotik etkisinde düşme olur.[65] Helyumun düşük çözünürlüğünun bunlardan başka bir getirisi de dekompresyon hastalığı olarak bilinen durumda ek avantajlar sağlamasıdır.[11][66] Vücutta çözünmüş gazın küçük miktarda bulunması, yükselme sırasında basınçtaki düşüşle birlikte daha az gazın kabarcık şekline dönüşmesi anlamına gelir. Diğer bir soy gaz argonun ise aletli dalış için kuru elbisede şişirme gazı olarak kullanımının en iyi seçenek olduğu kabul edilir. [67]

1937'deki Hindenburg faciasından sonra,[68] helyum, yüzme özelliğindeki %8.6[69] düşüşe rağmen[11] hafifliği ve tutuşmazlığı sebebiyle zeplin ve balonlarda kaldırma gazı olarak hidrojenin yerini aldı.
Birçok uygulamada soy gazlar inert atmosfer (nötr veya yansız atmosfer) sağlamak amacıyla kullanılır. Argon azota hassas olan havaya hassas bileşiklerin sentezinde kullanılır. Katı argon ayrıca, reaksiyon ara ürünleri gibi çok kararsız bileşiklerin araştırılmasında da kullanılır. Bu araştırmalarda bileşikler çok düşük sıcaklıklarda bir inert matrikste tuzaklanır.[70] Helyum gaz kromatografisinde taşıyıcı ortam olarak, termometrelerde gaz dolgusu olarak ve kabarcık odası ve Geiger sayacı gibi radyasyon ölçmeye yarayan aletlerde kullanılır.[61] Helyum ve argon genellikle ark kaynaklarında koruma oluşturması için kullanılır ve kaynak ve kesme esnasında ana metalin etrafını sarar. Ayrıca diğer metalurjik süreçlerde ve yarı iletken endüstrisindeki silisyum ve germanyum üretiminde koruyucu soy gaz olarak kullanılır.[60]

Soy gazlar düşük kimyasal reaksiyon ilgisi nedeniyle aydınlatmada sıkça kullanılır. Azot ile karıştırılan argon, akkor lambalar için gaz dolgusu olarak kullanılır.[60] Daha yüksek renk sıcaklığına ve verimliliğe sahip kripton, yüksek performanslı lambalarda kullanılır çünkü o filamanın buharlaşma oranını argondan daha fazla düşürür. Halojen lambalarda, özellikle az miktarda iyot ve brom bileşikleri ile karıştırılan kripton kullanır.[60] Soy gazlar gaz deşarj lambalarında kullanıldığında ayırdedici renklerde korlaşırlar. Ksenon genellikle ksenon ark lambalarında kullanılır. Bu lambalar neredeye sürekli spektrumları sayesinde gün ışığını andırır ve film projektörleri ve otomobil farları gibi uygulamalarda kullanılır.[60]
Soy gazlar, eksimer olarak bilinen kısa ömürlü, elektronik olarak uyarılmış molekkülleri temel alan eksimer lazerlerde kullanılır. Lazerler için kullanılan eksimerler Ar2, Kr2 veya Xe2 gibi soy gaz dimerleri olabilir veya daha yaygını soy gazlar ArF, KrF, XeF veya XeCl gibi eksimerlerde bir halojenle birleşebilir. Bu lazerler kısa dalgaboyu sebebiyle (ArF için 193 nm ve KrF için 248 nm) yüksek hassasiyetli görüntülemeye fırsat veren morötesi ışık üretir. Bunlar, tümleşik devre imalatında ve lazer anjiyoplasti ve göz cerrahisi gibi lazer ameliyatlarında temel gereksinim olan mikrolitografi ve mikrofabrikasyon için kullanılır.[71]
Bazı soy gazlar tıpta doğrudan kullanıma sahiptir. Helyum bazen astım hastalarının solunumunu kolaylaştırmak için kullanılır.[60] Ksenon, azot oksitten daha etkili olmasını sağlayan yağdaki yüksek çözünürlüğü ve daha hızlı geri dünüşüm sağlayan vücuttan çabucak çıkabilmesi sebebiyle, anestezik olarak kullanılır.[72] Ksenon hiperpolarize edilmiş MRI yoluyla akciğerlerin tıbbi görüntülenmesinde kullanılır.[73] Son derece radyoaktif olan ve sadece dakikalarla var olabilen radon radyoterapide kullanılır.[11]
- Neon tüplerinde kullanılan farklı soy gazların ürettiği renkler.





Ayrıca bakınız
Notlar
- ↑ See references given in Ununoctium (last sentence of the introduction)
- ↑ See reference given in Ununquadium.
- ↑ Renouf, Edward (1901-02-15). "Noble gases". Science 13: 268–270. DOI:10.1126/science.13.320.268.
- ↑ Ozima 2002, s. 30
- ↑ Ozima 2002, s. 4
- ↑ "argon". Encyclopædia Britannica. 2008. http://www.britannica.com/eb/article-9009382/argon.
- ↑ Oxford English Dictionary (1989), s.v. "helium". Retrieved December 16, 2006, from Oxford English Dictionary Online. Also, from quotation there: Thomson, W. (1872). Rep. Brit. Assoc. xcix: "Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium."
- 1 2 Ozima 2002, s. 1
- ↑ Mendeleev 1903, s. 497
- ↑ Partington, J. R. (Mayıs 1957). "Discovery of Radon". Nature 4566: 912. DOI:10.1038/179912a0.
- 1 2 3 4 5 6 7 8 9 10 "Noble Gas". Encyclopædia Britannica. 2008. http://www.britannica.com/eb/article-9110613/noble-gas.
- ↑ Cederblom, J. E. (1904). "The Nobel Prize in Physics 1904 Presentation Speech". 10 Haziran 2016 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20160610015419/http://www.nobelprize.org/nobel_prizes/physics/laureates/1904/press.html.
- ↑ Cederblom, J. E. (1904). "The Nobel Prize in Chemistry 1904 Presentation Speech". 10 Haziran 2016 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20160610020943/http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1904/press.html.
- ↑ Gillespie, R. J.; Robinson, E. A. (Ocak 2007). "Gilbert N. Lewis and the chemical bond: the electron pair and the octet rule from 1916 to the present day". J Comput Chem 28: 87–97. DOI:10.1002/jcc.20545. PMID 17109437.
- 1 2 Bartlett, N. (1962). "Xenon hexafluoroplatinate Xe+[PtF6]–". Proceedings of the Chemical Society: 218. DOI:10.1039/PS9620000197.
- ↑ Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. (1962). "Radon Fluoride". Journal of the American Chemical Society 84: 4164–4165. DOI:10.1021/ja00880a048.
- ↑ Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V. (1963). "Krypton Tetrafluoride: Preparation and Some Properties". Science 139: 1047–1048. DOI:10.1126/science.139.3559.1047. PMID 17812982.
- ↑ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (2000-08-24). "A stable argon compound". Nature 406: 874–876. DOI:10.1038/35022551.
- ↑ Woods, Michael (2003-05-06). "Chemical element No. 110 finally gets a name—darmstadtium". Pittsburgh Post-Gazette. 24 Ocak 2012 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20120124210656/http://www.post-gazette.com/healthscience/20030506element0506p4.asp. Erişim tarihi: 2008-06-26.
- ↑ Oganessian, Yu. Ts. (1999). "Synthesis of Superheavy Nuclei in the 48Ca + 244Pu Reaction". Physical Review Letters (American Physical Society) 83: 3154. DOI:10.1103/PhysRevLett.83.3154.
- ↑ "Gas Phase Chemistry of Superheavy Elements" (PDF). Texas A&M University. http://lch.web.psi.ch/files/lectures/TexasA&M/TexasA&M.pdf. Erişim tarihi: 2008-05-31.
- ↑ Oganessian, Yu. Ts. (2006-10-09). "Synthesis of the isotopes of elements 118 and 116 in the Şablon:SimpleNuclide and Şablon:SimpleNuclide + Şablon:SimpleNuclide fusion reactions". Physical Review C 74 (4): 44602. DOI:10.1103/PhysRevC.74.044602.
- ↑ Wilson, Elaine (2005). "Making Meaning in Chemistry Lessons". Electronic Journal of Literacy through Science 4 (2).
- 1 2 3 4 Greenwood 1997, s. 891
- ↑ Under pressure of 25 bar
- ↑ Allen, Leland C. (1989). "Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms". Journal of the American Chemical Society 111: 9003. DOI:10.1021/ja00207a003.
- ↑ "Solid Helium". University of Alberta. 5 Kasım 2008 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20081105093749/http://www.phys.ualberta.ca:80/~therman/lowtemp/projects1.htm. Erişim tarihi: 2008-06-22.
- ↑ Wheeler, John C. (1997). "Electron Affinities of the Alkaline Earth Metals and the Sign Convention for Electron Affinity". Journal of Chemical Education 74: 123–127.; Kalcher, Josef; Sax, Alexander F. (1994). "Gas Phase Stabilities of Small Anions: Theory and Experiment in Cooperation". Chemical Reviews 94: 2291–2318. DOI:10.1021/cr00032a004.
- ↑ "Scientists Announce Creation of Atomic Element, the Heaviest Yet". Washington Post. 2006-10-17. http://www.washingtonpost.com/wp-dyn/content/article/2006/10/16/AR2006101601083.html. Erişim tarihi: 2008-06-26.
- ↑ Ozima 2002, s. 35
- ↑ CliffsNotes 2007, s. 15
- 1 2 3 4 5 6 7 8 Grochala, Wojciech (2007). "Atypical compounds of gases, which have been called noble". Chemical Society Reviews 36 (36): 1632–1655. DOI:10.1039/b702109g.
- ↑ Pauling, Linus (June 1933). "The Formulas of Antimonic Acid and the Antimonates". Journal of the American Chemical Society 55 (5): 1895–1900. DOI:10.1021/ja01332a016.
- ↑ Holloway 1968
- ↑ Seppelt, Konrad (June 1979). "Recent developments in the Chemistry of Some Electronegative Elements". Accounts of Chemical Research 12: 211–216. DOI:10.1021/ar50138a004.
- ↑ Moody, G. J. (October 1974). "A Decade of Xenon Chemistry". Journal of Chemical Education 51 (10): 628–630. http://www.eric.ed.gov/ERICWebPortal/custom/portlets/recordDetails/detailmini.jsp?_nfpb=true&_&ERICExtSearch_SearchValue_0=EJ111480&ERICExtSearch_SearchType_0=no&accno=EJ111480. Erişim tarihi: 2007-10-16.
- ↑ Zupan, Marko; Iskra, Jernej; Stavber, Stojan (1998). "Fluorination with XeF2. 44. Effect of Geometry and Heteroatom on the Regioselectivity of Fluorine Introduction into an Aromatic Ring". J. Org. Chem 63: 878–880. DOI:10.1021/jo971496e.
- ↑ Harding 2002, ss. 90–99
- ↑ .Avrorin, V. V.; Krasikova, R. N.; Nefedov, V. D.; Toropova, M. A. (1982). "The Chemistry of Radon". Russian Chemical Review 51: 12–20. DOI:10.1070/RC1982v051n01ABEH002787.
- ↑ http://dx.doi.org/10.1016/S0010-8545(02)00202-3 doi:10.1016/S0010-8545(02)00202-3
- ↑ Hogness, T. R.; Lunn, E. G. (1925). "The Ionization of Hydrogen by Electron Impact as Interpreted by Positive Ray Analysis". Physical Review 26: 44–55. DOI:10.1103/PhysRev.26.44.
- ↑ Fernandez, J.; Martin, F. (2007). "Photoionization of the HeH2+ molecular ion". J. Phys. B: At. Mol. Opt. Phys 40: 2471–2480. DOI:10.1088/0953-4075/40/12/020.
- ↑ H. M. Powell and M. Guter (1949). "An Inert Gas Compound". Nature 164: 240–241. DOI:10.1038/164240b0.
- ↑ Greenwood 1997, s. 893
- ↑ Yuri A. Dyadin, Eduard G. Larionov, Andrei Yu. Manakov, Fridrich V. Zhurko, Evgeny Ya. Aladko, Tamara V. Mikina, Vladislav Yu. Komarov (1999). "Clathrate hydrates of hydrogen and neon". Mendeleev Communications 9: 209–210. DOI:10.1070/MC1999v009n05ABEH001104.
- ↑ Saunders, M.; Jiménez-Vázquez, H. A.; Cross, R. J.; Poreda, R. J. (1993). "Stable compounds of helium and neon. He@C60 and Ne@C60". Science 259: 1428–1430. DOI:10.1126/science.259.5100.1428. PMID 17801275.
- ↑ Saunders, Martin; Jimenez-Vazquez, Hugo A.; Cross, R. James; Mroczkowski, Stanley; Gross, Michael L.; Giblin, Daryl E.; Poreda, Robert J. (1994). "Incorporation of helium, neon, argon, krypton, and xenon into fullerenes using high pressure". J. Am. Chem. Soc. 116: 2193–2194. DOI:10.1021/ja00084a089.
- ↑ Frunzi, Michael; Cross, R. James; Saunders, Martin (2007). "Effect of Xenon on Fullerene Reactions". Journal of the American Chemical Society 129: 13343. DOI:10.1021/ja075568n.
- ↑ Greenwood 1997, s. 897
- ↑ Weinhold 2005, ss. 275–306
- ↑ Pimentel, G. C. (1951). "The Bonding of Trihalide and Bifluoride Ions by the Molecular Orbital Method". The Journal of Chemical Physics 19 (4): 446–448. DOI:10.1063/1.1748245.
- ↑ Weiss, Achim. "Elements of the past: Big Bang Nucleosynthesis and observation". Max Planck Institute for Gravitational Physics. 28 Mayıs 2010 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20100528192437/http://www.einstein-online.info:80/en/spotlights/BBN_obs/index.html. Erişim tarihi: 2008-06-23.
- ↑ Coc, A.; et al. (2004). "Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements". Astrophysical Journal 600: 544. DOI:10.1086/380121.
- ↑ Morrison, P.; Pine, J. (1955). "Radiogenic Origin of the Helium Isotopes in Rock". Annals of the New York Academy of Sciences 62: 71–92. DOI:10.1111/j.1749-6632.1955.tb35366.x.
- ↑ Scherer, Alexandra (2007-01-16). "40Ar/39Ar dating and errors". Technische Universität Bergakademie Freiberg. 5 Mart 2016 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20160305222402/http://geoberg.de/text/geology/07011601.php. Erişim tarihi: 2008-06-26.
- ↑ Sanloup, Chrystèle; et al. (2005). "Retention of Xenon in Quartz and Earth's Missing Xenon". Science 310: 1174–1177. DOI:10.1126/science.1119070. PMID 16293758.
- ↑ "A Citizen's Guide to Radon". U.S. Environmental Protection Agency. 2007-11-26. 28 Haziran 2013 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20130628142646/http://www.epa.gov/radon/pubs/citguide.html. Erişim tarihi: 2008-06-26.
- ↑ Lodders, Katharina (2003). "Solar System Abundances and Condensation Temperatures of the Elements". The Astrophysical Journal 591: 1220–1247. DOI:10.1086/375492.
- ↑ "The Atmosphere". National Weather Service. 19 Aralık 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20151219104633/http://www.srh.noaa.gov:80/jetstream/atmos/atmos_intro.htm. Erişim tarihi: 2008-06-01.
- 1 2 3 4 5 6 7 Häussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann (2002). "Noble gases". Ullmann's Encyclopedia of Industrial Chemistry. Wiley. DOI:10.1002/14356007.a17_485.
- 1 2 Hwang, Shuen-Chen; Lein, Robert D.; Morgan, Daniel A. (2005). "Noble Gases". Kirk Othmer Encyclopedia of Chemical Technology. Wiley. s. 343–383. DOI:10.1002/0471238961.0701190508230114.a01.
- ↑ "Neon". Encarta. 2008.
- ↑ Zhang, C. J.; Zhou, X. T.; Yang, L. (January 1992). "Demountable coaxial gas-cooled current leads for MRI superconducting magnets". Magnetics, IEEE Transactions on (IEEE) 28: 957–959. DOI:10.1109/20.120038.
- ↑ Fowler, B; Ackles, K. N.; Porlier, G. (1985). "Effects of inert gas narcosis on behavior—a critical review". Undersea Biomed. Res. 12 (4): 369–402. ISSN 0093-5387. OCLC 2068005. PMID 4082343. http://archive.rubicon-foundation.org/3019. Erişim tarihi: 2008-04-08.
- ↑ Bennett 1998, s. 176
- ↑ Vann, R. D. (ed) (1989). "The Physiological Basis of Decompression". 38th Undersea and Hyperbaric Medical Society Workshop 75(Phys)6-1-89: 437. http://archive.rubicon-foundation.org/6853. Erişim tarihi: 2008-05-31.
- ↑ Maiken, Eric (2004-08-01). "Why Argon?". Decompression. 6 Aralık 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20151206190126/http://www.decompression.org:80/maiken/Why_Argon.htm. Erişim tarihi: 2008-06-26.
- ↑ "Disaster Ascribed to Gas by Experts". The New York Times: s. 1. 1937-05-07.
- ↑ Freudenrich, Craig (2008). "How Blimps Work". HowStuffWorks. 29 Nisan 2010 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20100429060014/http://science.howstuffworks.com:80/blimp2.htm. Erişim tarihi: 2008-07-03.
- ↑ Dunkin, I. R. (1980). "The matrix isolation technique and its application to organic chemistry". Chem. Soc. Rev. 9: 1–23. DOI:10.1039/CS9800900001.
- ↑ Basting, Dirk; Marowsky, Gerd (2005). Excimer Laser Technology. Springer. ISBN 3540200568.
- ↑ Sanders, Robert D.; Ma, Daqing; Maze, Mervyn (2005). "Xenon: elemental anaesthesia in clinical practice". British Medical Bulletin 71: 115–135. DOI:10.1093/bmb/ldh034. PMID 15728132.
- ↑ Albert, M. S.; Balamore, D. (1998). "Development of hyperpolarized noble gas MRI". Nuclear Instruments and Methods in Physics Research A 402: 441–453. DOI:10.1016/S0168-9002(97)00888-7. http://www.ncbi.nlm.nih.gov/sites/entrez?cmd=Retrieve&db=PubMed&list_uids=11543065&dopt=AbstractPlus. Erişim tarihi: 2007-10-01.
Kaynakça
- Bennett, Peter B.; Elliott, David H. (1998). The Physiology and Medicine of Diving. SPCK Publishing. ISBN 0702024104.
- Bobrow Test Preparation Services (2007-12-05). CliffsAP Chemistry. CliffsNotes. ISBN 047013500X.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd bas.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Harding, Charlie J.; Janes, Rob (2002). Elements of the P Block. Royal Society of Chemistry. ISBN 0854046909.
- Holloway, John H. (1968). Noble-Gas Chemistry. Londra: Methuen Publishing. ISBN 0412211009.
- Mendeleev, D. (1902–1903) (Rusça). Osnovy Khimii (The Principles of Chemistry) (7th bas.). http://www.archive.org/details/principlesofchem00menduoft.
- Ozima, Minoru; Podosek, Frank A. (2002). Noble Gas Geochemistry. Cambridge University Press. ISBN 0521803667. http://books.google.com/books?id=CBM2LJDvRtgC.
- Weinhold, F.; Landis, C. (2005). Valency and bonding. Cambridge University Press. ISBN 0521831288.