Protein yapısı
Proteinler her organizmada bulunan önemli bir makromolekül sınıfıdır. Proteinler, 20 farklı tip L-α-amino asitten meydana gelen polimerlerdir. Amino asitler birbiriyle reaksiyona girdikten sonra meydan gelen polimerde bu amino asitlerden arta kalan birimlere amino asit kalıntısı denir. 40 kalıntıdan daha kısa olan zincirler için protein yerine genelde peptit terimi kullanılır. Biyolojik fonksiyonlarını yerine getirebilmek için proteinler uzay içinde belli bir biçim alacak şekilde katlanırlar. Bu katlanmayı yönlendiren güçler, protein atomları arasındaki hidrojen bağı, iyonik etkileşimler, Van Der Waals güçleri ve hidrofobik istiflenme gibi, kovalent olmayan etkleşimlerdir. Proteinlerin işlevlerini moleküler düzeyde anlayabilmek için genelde onları üç boyutlu yapısının çözülmesi gerekir. Protein yapısını çözmek için X-ışını kristalografisi ve NMR spektroskopisi kullanılır, bunlar yapısal biyolojinin başlıca yöntemleri arasında yer alır.
Proteinlerdeki amino asit kalıntı sayısı birkaç on ile birkaç bin arasında değişebilir.[1] Bazı proteinler daha büyük yapıların protein altbirimidirler. Örneğin, binlerce aktin molekülü bir araya gelerek mikrofilamanları meydana getirir.
Bır protein biyolojik işlevini yerine getirirken tersinir bir yapısal değişiklik geçirebilir. Aynı proteinin alternatif yapıları farklı konformasyonlar olarak adlandırılır, bunlar arasındaki geçişlere konformasyon değişikliği denir.
Protein kovalent yapısı ve stereokimyası
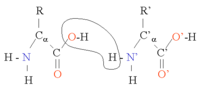
Protein amino asitleri bir yoğunlaşma reaksiyonu ile birleşerek bir polipeptit zincir oluştururlar. Canlılarda bu reaksiyon çeviri denen bir süreç ile ribozomlarda gerçekleşir.
Ribozomlar tarafından imal edilen doğal proteinlerde bulunan 20 amino asit farklı fiziksel ve kimyasal özelliklere sahiptir. Taşıdıkları elektrostatik yük, hidrofobiklikleri, asit ayrışma katsayıları (pKa), büyüklükleri ve fonksiyonel grupları farklılık gösterir. Bu özellikler proteinlerin yapısını belirlemekte önemli rol oynar.
Amino asit kalıntıları
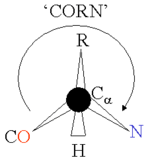
Her α-amino asitte bir omurga bölümü vardır, ki bu tüm amino asit tiplerinde mevcuttur, ve bir yan zincir vardır, ki bu her amino asidin kendisine hastır. Amino asitlerin çoğunda alfa karbon atomu dört farklı kimyasal gruba bağlı olduğu için, kiraldir; bir tek glisin kiral değildir, çünkü yan zinciri bir hidrojen atomudur. Canlılarda bulunan proteinler, L-amino asitlerden oluşur. L-biçimini hatırlamak için "CORN" kelimesi bir hatırlatıcı (belleksel) olarak kullanılabilir: Cα atomuna H önde olacak şekilde bakılırsa, karbona bağlı diğer üç grup, saat yönünde, "CO-R-N" olarak okunabilir.
Peptit bağı
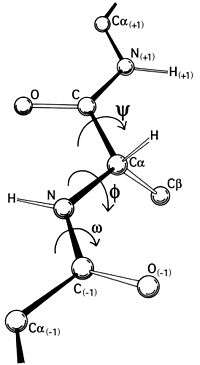
Peptit bağı düzlemsel olma eğilimlidir, çift bağdaki elektronların yerelliğinin bozulması (delokalizasyonu) nedeniyle. Peptitte C1 ile N arasındaki dihedral omega (ω) açısı açısı esneklik göstermez, değeri hemen her zaman 180 dereceye yakındır. N ve C arasındaki dihedral fi (φ) açısı ve C ile C1 arasındaki dihedral psi (ψ) ise belli aralıkta değerlere sahip olabilir. Bu açılar bir proteinin dahili serbestlik derecesidir, proteinin konformasyonunu kontrol ederler. Proteinlerde bulunan belli ikincil yapı elemanlarında bu açıların sahip olabileceği değerler geometrik nedenlerle belli aralıklar içinde sınırlanmışlardır. Psi ve Fi açılarındaki sınırlamalar Ramachandran grafiği ile görülebilir. Birkaç önemli bağ hakkında bilgi aşağıdaki tabloda gösterilmiştir.
| Peptit bağı | Ortalama uzunluk | Tek bağ | Ortalama uzunluk | Hidrojen bağı | Ortalama (±30) |
| C–C | 153 pm | C–C | 154 pm | O–H --- O–H | 280 pm |
| C–N | 133 pm | C–N | 148 pm | N–H --- O=C | 290 pm |
| N–C | 146 pm | C–O | 143 pm | O–H --- O=C | 280 pm |
Yan zincir konformasyonları
Yan zincirlerdeki atomlar Yunan harfleri ile, Yunanca alfabetik sırayla adlandırılır: α, β, γ, δ, є, vs. C omurga üzerinde, amino asidin karbonil grubuna en yakın karbon bağına karşılık gelir. Bu atomlar arasındaki dihedral açılar χ1, χ2, χ3, vs. olarak adlandırılır. Yan zincirinin hareket edebilen ilk atomunun () dihedral açısı (χ1), N-C-C- olarak tanımlanır. Yan zincirler birbiriyle çakışmayacak şekilde düzenlenirler, sp3-sp3 bağları etrafında 60°, 180°, ve -60° açılarla dizilme eğilimi gösterirler. Bu pozisyonlara sırasıyla gauche(-), trans, ve gauche(+) adları verilir. Yan zincir dihedral açıları eşit bir dağılım göstermezler, çoğu yan zincir tipleri için açıları belli değerler etrafında öbeklenir.[2][3]
Protein yapısının düzeyleri

Protein yapısının dört düzeyi vardır.
Birincil yapı
Birincil yapı, bir polipeptit zincirin amino asit dizisidir. Birincil yapı peptit bağlarla bir arada durur, bunlar protein sentezi sırasında meydana gelir. Polipeptit zincirin iki ucu, uçlardaki serbest grubun cinsine bağlı olarak karboksil uç (veya C-uç) ve amino uç (veya N-uç) olarak adlandırılır. Amino asit kalınıtıları N-ucundan başlar, buradaki amino (NH2-group) grubu bir peptit bağı içinde yer almaz. Canlılarda bir proteinin birincil yapısı o proteini kodlayan gen tarafından belirlenir. DNA'daki belli bir nükleotit dizisi (bir gen) okunarak bir mRNA sentezlenir, mRNA da, çeviri olarak adlandırılan bir süreç sonucu, ribozomlar tarafından okunup, genin ürünü olan proteinin sentezlenmesini sağlar. Proteinin dizisi o proteine spesifiktir, proteinin yapısı ve fonksiyonunu belirler. Bir proteinin dizisi Edman yıkımı veya kütle spektrometresi gibi yöntemlerle belirlenebilir. Ancak, çoğu zaman, o proteini kodlayan genin dizisi doğrudan okunarak (bunun için genetik kod kullanılır) proteinin dizisi belirlenir. Çevrim sonrası değişimler, disülfür oluşumu, fosforilasyon ve glikozilasyonlar gibi, genelde birincil yapının parçası sayılırlar ama gen dizisi okunarak bunların varlığı gösterilemez.
İkincil yapı
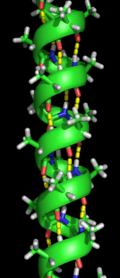
Proteinlerde ikincil yapı, çok düzenli yerel alt yapılardır. Alfa sarmal ve beta yaprak olarak adlandırılan iki ana ikincil yapı tipi, 1951'de Linus Pauling ve arkadaşları tarafından önerilmiştir.[4] Bu ikincil yapılar, protein omurgasındaki atomlar arasındaki hidrojen bağı örüntüleri ile tanımlanır. Düzenli bir geometriye sahiptir, Ramachandran grafiğinde belli ψ ve φ açıları ile kısıtlanmıştır. Alfa sarmal ve beta yapraklar, peptit omurga üzerindeki hidrojen bağı verici ve alıcılarınının doymasını sağlayan yerel yapılardır. Proteinlerin bazı kısımları yapılıdır ama düzenli değildir. Bu kısımlar rastgele sarım ile karıştırılmamalıdır; rastgele sarım, belli bir sabit üç boyutlu yapıya sahip olmayan, katlanmamış polipeptit zinciridir. Birbirini izleyen birkaç ikincil yapı bir "süperikincil birim" oluşturabilir.[5]
Üçüncül yapı
Üçüncül yapı, tek bir protein molekülünün üç boyutlu yapısıdır. Alfa sarmal ve beta yapraklar kompakt bir yapı oluşturacak şekilde katlanırlar. Bu katlanma hidrofobik etkileşimler (hidrofobik kalıntıların sudan uzaklaştırılması) tarafında yönlendirilir ama yapının stabil olabilmesi için spesifik üçüncül etkileşimlerle (tuz köprüleri, hidrojen bağları, disülfür bağları ve yaz zincirlerin sıkı istiflenmesi gibi) bir protein bölgesinin kısımlarının yerinin sabitlenmesi gerekir.
Dördüncül yapı
Dördüncül yapı birkaç protein veya polipeptit zincirinin (bu bağlamda bunlara protein altbirim denir) bir araya gelmesinden meydana gelen büyük bir toplaşmadır. Dördüncül yapı, üçüncül yapıyı stabilize eden, kovalent olmayan bağlar ve disülfür bağları tarafından stabilize edilir. İki ve daha çok (yani mültipl) polipeptitten oluşan kompleksler mültimer olarak adlandırılır. Daha spesifik olarak, böylesi bir yapı eğer iki altbirimden oluşuyorlarsa dimer, üç altbirimden oluşuyorlarsa trimer, ve dört altbirimden oluşuyorlarsa tetramer olarak adlandırılır. Altbirimler genelde birbirlerine simetri işlemleri ile ilişkilidir, örneğin bir dimerde iki katlı bir simetri ekseni vardır. Birbirinin aynı altbirimlerden oluşan mültimerlere değinirken "homo-" öneki kullanılır (örneğin bir homotetramer), farklı altbirimlerden oluşanlar için ise "hetero-" öneki kullanılır (örneğin bir heterotetramer, iki alfa ve iki beta zinciri olan hemoglobinden bahsederken). Çoğu proteinin dördüncül yapısı yoktur ve monomer olarak işlev görür.
Bölgeler, motifler ve katlamalar
Proteinlerden bahsederken sıkça aşağıdaki yapısal birimlere değinilir.
- Bir yapısal bölge (yapısal alan da denir) proteinin yapısının bir unsurudur, kendi kendini stabilize eder ve genelde protein zincirinin geri kalanından bağımsız olarak katlanır. Çoğu bölge (İngilizce domain), sadece bir gen veya gen ailesinin gen ürünlerine has değildir ve çeşitli proteinlerde görülür. Bölgeler, ait oldukları proteinin biyolojik fonksiyonu içinde belirgin bir yere sahip oldukları için bununla ilişkili biçimde adlandırılırlar; örneğin, "kalmodulin'in kalsiyum bağlayıcı bölgesi" denir. Kendi başlarına kararlı oldukları için, genetik mühendislikle bir proteine ait bir bölge bir diğerininki ile "takas" edilip kimeralar elde edilebilir.
- Yapısal ve dizi motifleri, çok sayıda proteinde görülen, protein üç boyutlu yapısındaki veya amino asit dizisindeki kısa parçalardır.
- Süperikincil yapı ikincil yapı elemanlarının belli bileşimleridir, örneğin beta-alfa-beta birimleri veya sarmal-dönme-sarmal motifleri gibi. Bazılarından yapısal motif olarak da bahsedilebilir.
- Protein katlaması, Proteinlerin Yapısal Sınıflandırması (SCOP) veritabanında belirtilen, sarmal demeti (helix bundle), beta fıçısı (beta barrel), Rossman katlaması gibi, genel mimari yapılardır.[6]
Ökaryotik sistemlerde yüzbinlerce farklı protein ifade edilmesine rağmen, bundan çok daha az sayıda farklı bölge, yapısal motif ve katlama vardır. Bu kısmen evrimin bir sonucudur, çünkü genler ve gen parçaları çiftlenebilir veya genom içinde yer değiştirebilir. Bu demektir ki, örneğin, bir protein bölgesi bir proteinden bir diğerine taşınabilir ve ikinci proteine yeni bir fonksiyon kazandırabilir. Bu tür mekanizmalar nedeniyle, yolaklar ve mekanizmalar farklı proteinlerde yeniden kullanılabilir.
Protein katlanması
Rastgele sarım şeklinde olan bir polipeptit katlanarak kendisine has üç boyutlu yapısını elde eder.
Protein yapı tespiti
Protein Data Bank adlı veritabanındaki protein yapılarının yaklaşık %90'ı X-ışını kritalografisi ile belirlenmiştir. Bu yöntem, (kristalleşmiş) bir proteindeki elektron dağılımının üç boyutlu (3B) yoğunluğunu ölçmeyi sağlar ve dolayısıyla tüm atomların 3B koordinatlarının belli bir çözünürlük ile çıkarımı mümkün olur. Yapısı bilinen proteinlerin yaklaşık %9'u Nükleer Manyetik Rezonans ile elde edilmiştir. Proteinin ikincil yapı bileşimi dairesel dikroizm veya ikili polarizasyon interferometrisi ile belirlenebilir. Kriyo-elektron mikroskopisi de bazı durumlarda protein yapısının yüksek (5 angstromdan düşük) çözünürlükle belirlenmesi için kullanılan bir yöntem olarak gelişmektedir. Bu yöntem özellikle çok büyük protein komplekslerinin (virüs kılıf proteinleri gibi) yapısının anlaşılması için hâlen mevcut olan tek yoldur.
Yapı sınıflandırması
Protein yapıları, benzerliklerine veya ortak evrimsel kökene dayanarak sınıflandırılabilir. SCOP ve CATH veritabanları iki farklı protein yapısal sınıflandırması sunmaktadır.
Protein yapısı için berimsel öngörü
Bir protein dizisini üretmek, bir proteinin yapısını çözmekten çok daha kolaydır. Ancak, bir proteinin yapısı onun işlevinin çok daha iyi anlaşılmasına olanak verir, sadece onun dizisini bilmeye kıyasla. Dolayısıyla, bir proteinin dizisinden yola çıkararak onun yapısının hesaplamalı (berimsel) öngörüsü için çeşitli yöntemler geliştirilmiştir.[7] Temel ilkelerden (Ab initio) öngörü yöntemleri sadece proteinin dizisini kullanır. İplik geçirme (İng. Threading) ve homoloji modellemesi yöntemleri kullanılarak, evrimsel ilişkili proteinlerin deneysel olarak çözülmüş yapılarına dayanarak bilinmeyen bir proteinin 3B modeli yapılabilir.
Protein yapısı ile ilişkili yazılım
Protein yapısının çeşitli cepheleri hakkında çalışan araştırmacılara yardımcı olan yazılımlar mevcuttur. Bu araştırmalarda gereken en temel işlevsellik, yapı görüntülemesi sağlamaktır. Protein yapısının analizi yapıları hizalayan yazılım ile kolaylaştırılır. Belli bir protein dizisi için yapı bilinmiyorsa, bilinen protein yapılarına dayanarak onun yapısını öngören veya modelleyen yazılımlar kullanılabilir. Ayrıca, model veya öngörü yapıları varsa, onlarda hata kontrolü yapmak için, protein konformasyonel değişimlerini öngörmek, veya substrat bağlanma konumların öngörmek için yazılımlar vardır.
Ayrıca bakınız
- Uzaklık geometrisi
- Protein tasarımı
- Protein dinamiği
- Protein yapı veritabanı
Kaynakça
- ↑ Brocchieri L, Karlin S (2005-06-10). "Protein length in eukaryotic and prokaryotic proteomes". Nucleic Acids Research 33 (10): 3390–3400. DOI:10.1093/nar/gki615. PMC 1150220. PMID 15951512. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=1150220.
- ↑ Dunbrack, RL (2002). "Rotamer Libraries in the 21st Century". Curr. Opin. Struct. Biol. 12 (4): 431–440. DOI:10.1016/S0959-440X(02)00344-5. PMID 12163064.
- ↑ Dunbrack Rotamer Libraries
- ↑ Pauling L, Corey RB, Branson HR (1951). "The structure of proteins; two hydrogen-bonded helical configurations of the polypeptide chain". Proc Natl Acad Sci USA 37 (4): 205–211. DOI:10.1073/pnas.37.4.205. PMC 1063337. PMID 14816373. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=1063337.
- ↑ Chiang YS, Gelfand TI, Kister AE, Gelfand IM (2007). "New classification of supersecondary structures of sandwich-like proteins uncovers strict patterns of strand assemblage.". Proteins. 68 (4): 915–921. DOI:10.1002/prot.21473. PMID 17557333.
- ↑ Govindarajan S, Recabarren R, Goldstein RA. (17 September 1999). "Estimating the total number of protein folds.". Proteins. 35 (4): 408–414. DOI:10.1002/(SICI)1097-0134(19990601)35:4<408::AID-PROT4>3.0.CO;2-A. PMID 10382668. http://www3.interscience.wiley.com/journal/65000323/abstract.
- ↑ Zhang Y (2008). "Progress and challenges in protein structure prediction". Curr Opin Struct Biol 18 (3): 342–348. DOI:10.1016/j.sbi.2008.02.004. PMC 2680823. PMID 18436442. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=2680823.
Daha çok okuma için
- Chiang YS, Gelfand TI, Kister AE, Gelfand IM (2007). "New classification of supersecondary structures of sandwich-like proteins uncovers strict patterns of strand assemblage.". Proteins. 68 (4): 915–921. DOI:10.1002/prot.21473. PMID 17557333. (İngilizce)
- Habeck M, Nilges M, Rieping W (2005). "Bayesian inference applied to macromolecular structure determination". Physical review. E, Statistical, nonlinear, and soft matter physics 72 (3 Pt 1): 031912. DOI:10.1103/PhysRevE.72.031912. PMID 16241487. (NMR verisinden yapı belirlemesi için Bayesian berimsel yöntemler) (İngilizce)
Dış bağlantılar
Wikiler
- Proteopedia — Protein yapıları ve diğer biyomoleküler hakkında kayıtlar
- TOPSAN — Yapısal genomik çerçevesinde protein yapıları hakkında bilgiler.
Sunucular
- SSS Database — protein super-ikincil yapı veritabanı
- SPROUTS (Structural Prediction for pRotein fOlding UTility System)